Dina SURDIN
Auteur
- 1
- 2
Articles
-
ACÉTAMIDE (éthanamide)
- Écrit par Dina SURDIN
- 328 mots
CH3—CO—NH2
Masse moléculaire : 59,07 g
Masse spécifique : 1,16 g/cm3
Point de fusion : 82 0C
Point d'ébullition : 222 0C.
Monoamide primaire se présentant en cristaux blancs hexagonaux ou rhomboédriques. La structure cristalline de l'acétamide déterminée par les rayons X (méthode du...
-
ACROLÉINE
- Écrit par Dina SURDIN
- 225 mots
Aldéhyde acrylique
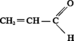
Masse moléculaire : 56,06 g
Masse spécifique : 0,841 g/cm3
Point d'ébullition : 52,5 0C
Point de fusion : —87,7 0C.
Liquide incolore, inflammable, à odeur âcre.
L'acroléine, ou propénal (prop-2-énal) possède les propriétés dues au groupement aldéhyde et à la présence...
-
ACTIVITÉ, chimie
- Écrit par Dina SURDIN
- 260 mots
Grandeur introduite par G. N. Lewis, en 1907, pour exprimer les propriétés thermodynamiques des solutions. En effet, l'expression du potentiel chimique d'un composé dans une solution idéale, donné par la relation μ = kT ln N + μ0, où N représente la fraction molaire du composé,...
-
ALCOXYLES RADICAUX
- Écrit par Dina SURDIN
- 50 mots
Groupements de formule générale RO— provenant d'un alcool par élimination d'un hydrogène ; par exemple, le groupement CH3—O— est appelé méthoxy- et provient du méthanol. Le groupement alcoxyle RO— est d'autant plus basique que l'alcool correspondant RO—H est moins acide.
-
AMMONIUM ION
- Écrit par Dina SURDIN
- 74 mots
L'ion ammonium, NH+4, présente des propriétés basiques et peut être comparé aux ions des métaux alcalins. L'ion ammonium se combine à l'oxhydrile OH— pour donner l'ammoniaque NH4OH.
Le chlorure d'ammonium, NH4Cl, est employé dans les piles sèches comme électrolyte....
-
ANTHRACÈNE
- Écrit par Dina SURDIN
- 233 mots
Formule brute : C14H10
Masse moléculaire : 178,22 g
Masse spécifique : 1,25 g/cm3
Point de fusion : 217 0C
Point d'ébullition : 354-355 0C.
Cet hydrocarbure cyclique cristallise en prismes monocliniques incolores et présente une fluorescence violette quand il est absolument pur.
L'énergie...
-
ARYLES RADICAUX
- Écrit par Dina SURDIN
- 34 mots
-
AZÉTIDINE ou TRIMÉTHYLÈNE-IMINE
- Écrit par Dina SURDIN
- 64 mots
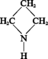
Masse moléculaire : 57,09 g
Masse spécifique : 0,843 g/cm3
Point d'ébullition : 63 0C.
Liquide incolore, fumant à l'air, d'odeur ammoniacale, soluble en toutes proportions dans l'eau et l'éthanol.
Le cycle à quatre chaînons s'ouvre facilement ; sous l'action de l'acide...
-
AZINES
- Écrit par Dina SURDIN
- 124 mots
Composés résultant de l'action des cétones ou des aldéhydes sur l'hydrazine.
Ils peuvent être soit en chaîne linéaire de formule générale R2C=N—N=CR2, soit cycliques dont la plus simple est la phénazine :
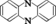
La phénazine et la phénazine N-substituée sont les deux produits de base...
-
AZIRIDINE ou AZACYCLOPROPANE ou DIMÉTHYLÈNIMINE
- Écrit par Dina SURDIN
- 159 mots

Masse moléculaire : 43,07 g
Masse spécifique : 0,832 g/cm3
Point d'ébullition : 56 0C
Huile à très forte odeur ammoniacale, fumant à l'air. Miscible à l'eau, soluble dans l'éthanol.
Également appelée azacyclopropane, diméthylènimine ou bien cyclodiméthylène amine, l'aziridine...
-
BENZÈNE
- Écrit par Dina SURDIN
- 477 mots
Le plus simple des hydrocarbures aromatiques.
Formule : C6H6
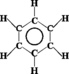
Fréquemment symbolisé par :
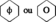
Masse moléculaire : 78,11 g
Masse spécifique : 0,88 g/cm3
Point de fusion : 5,5 0C
Point d'ébullition : 80,09 0C.
Cristaux incolores dans le système orthorhombique bipyramidal. Forme un azéotrope...
-
CAPROLACTAME
- Écrit par Dina SURDIN
- 104 mots

Masse moléculaire : 113,16 g
Masse spécifique : 1,02 g/cm3
Point de fusion : 70 0C
Point d'ébullition : 100 0C sous 3 millimètres de mercure.
Recristallise en feuillets hygroscopiques dans l'éther de pétrole. Soluble dans l'eau, le méthanol, l'éthanol, l'éther et le diméthoxyformamide....
-
CARBONYLATION
- Écrit par Dina SURDIN
- 24 mots
Réaction par laquelle on fait apparaître un groupement carbonyle

c'est-à-dire une fonction cétone

ou aldéhyde

dans une molécule.
-
CARBOXYLATION
- Écrit par Dina SURDIN
- 34 mots
Réaction par laquelle on introduit la fonction acide COOH dans une molécule. Inversement, la décarboxylation élimine du dioxyde de carbone, CO2, et fait disparaître la fonction acide.
-
CYANINES
- Écrit par Dina SURDIN
- 141 mots
Il existe deux composés connus sous le nom de cyanines. L'un a pour formule brute C27H30O16 et sa masse moléculaire est de 620,23 g. On l'appelle également cyanidine diglucoside-3-5. C'est un glucoside extrait des fleurs de bleuet, qui s'hydrolyse en cyanidine. Il fait partie de la famille...
-
CYCLOPENTADIÈNE
- Écrit par Dina SURDIN
- 327 mots
Cyclène de formule :

Masse moléculaire : 66,10 g
Masse spécifique : 0,8047 g/cm3
Point de fusion : —85 0C
Point d'ébullition : 42 0C
Liquide incolore.
Insoluble dans l'eau ; soluble dans le sulfure de carbone, l'aniline, l'acide acétique. Miscible à l'éthanol, à l'éther, au benzène et...
-
DÉGRADATION, chimie
- Écrit par Dina SURDIN
- 36 mots
Réaction par laquelle une molécule organique est coupée au niveau d'une liaison carbone-carbone. Les réactions de dégradation sont utilisées en particulier dans l'industrie pétrolière (craquage).
-
DIACÉTYLÈNE
- Écrit par Dina SURDIN
- 79 mots
CH≡C—C≡CH
Masse moléculaire : 50,06 g
Masse spécifique : 2,233 g/cm3
Point de fusion : — 36,4 0C
Point d'ébullition : 10,3 0C.
Cet hydrocarbure insaturé donne des réactions d'addition. L'addition de brome sur les triples liaisons est incomplète ; lors de la bromation, le diacétylène...
-
EAU RÉGALE
- Écrit par Dina SURDIN
- 223 mots
Mélange de deux ou trois volumes d'acide chlorhydrique concentré et d'un volume d'acide nitrique concentré. Les alchimistes ont appelé ce mélange « eau régale » (c'est-à-dire royale) pour ses propriétés : il dissout en effet l'or et d'autres métaux dits nobles....
-
ENTRAÎNEUR, chimie
- Écrit par Dina SURDIN
- 171 mots
Substance que l'on ajoute à un mélange afin d'entraîner un composé présent dans le mélange à l'état de traces. Il s'agit d'une technique particulièrement utilisée en chimie nucléaire.
L'efficacité d'un entraîneur est due, le plus souvent, à la similitude de ses...
-
ÉRYTHRITE, chimie
- Écrit par Dina SURDIN
- 113 mots
Polyol de formule :CH2OH—CHOH—CHOH—CH2OH.
Masse moléculaire : 122,12 g.
Masse spécifique : 1,45 g/cm3.
Point de fusion : 119-120 0C.
Point d'ébullition : 331 0C.
Corps polymorphe, cristallisé à partir de ses solutions aqueuses, l'érythrite (syn. érythritol) se présente sous la forme...
-
ÉTHANAL ou ACÉTALDÉHYDE ou ALDÉHYDE ACÉTIQUE
- Écrit par Dina SURDIN
- 453 mots
Appelé parfois improprement acétaldéhyde, aldéhyde acétique
ou aldéhyde éthylique
CH3—CHO
Masse moléculaire : 44,05 g
Point d'ébullition : + 21 0C
Liquide incolore, inflammable, à odeur caractéristique, infiniment soluble dans l'eau, l'éthanol, l'éther, le ...
-
FEHLING LIQUEUR DE
- Écrit par Dina SURDIN
- 132 mots
Mélange à volumes égaux des deux solutions suivantes : 34,64 g de sulfate de cuivre additionnés de quelques gouttes d'acide sulfurique dilué dans 500 millilitres d'eau, pour la première solution ; 60 grammes de soude additionnés de 173 grammes de tartrate double de sodium et de potassium (sel de Seignette)...
-
GÉMINATION, chimie
- Écrit par Dina SURDIN
- 88 mots
Processus par lequel deux substituants identiques se fixent sur un même carbone. Ainsi le dibromo-1,1-éthane peut également être appelé gem-dibromoéthane. Ce terme indique donc la position relative des substituants. Un carbone peut être gem-disubstitué par des groupements fonctionnels monovalents....
-
GRIGNARD VICTOR (1871-1935)
- Écrit par Dina SURDIN
- 156 mots
Chimiste français, né à Cherbourg, Victor Grignard étudie d'abord les mathématiques à Lyon, puis se tourne vers la chimie. En 1900-1901, exploitant une idée ébauchée par son professeur P. A. Barbier, il met au point et développe une réaction, dite depuis réaction de Grignard, qui revêt une très grande...
-
HALES STEPHEN (1677-1761)
- Écrit par Dina SURDIN
- 257 mots
- 1 média
Physiologiste, chimiste et inventeur anglais, né à Bekesbourne, dans le comté de Kent. Après des études au collège Corpus Christi à Cambridge, Stephen Hales devient pasteur et, en 1709, il obtient la charge perpétuelle de la cure de Teddington, dans le Middlesex. C'est là qu'il passe le reste de sa...
-
HYDROQUINONE
- Écrit par Dina SURDIN
- 172 mots
Benzène-1,4-diol ou paradiphénol C6H4 (OH)2.
Masse moléculaire : 110,11 g
Masse spécifique : 1,358 g/cm3
Point de fusion : 170,5 0C
Point d'ébullition : 286,2 0C.
Composé dimorphe : cristallise en prismes hexagonaux incolores après recristallisation dans l'eau, ou en feuilles monocliniques....
-
IMIDURES
- Écrit par Dina SURDIN
- 67 mots
-
INDAMINE
- Écrit par Dina SURDIN
- 112 mots

Masse moléculaire : 197,3 g.
L'indamine, ou bleu de phénylène, s'utilise principalement comme intermédiaire pour la préparation de colorants, aziniques en particulier.
Les indamines en général sont des colorants dérivés de l'indo-aniline et comportant le groupement =NH au lieu de l'oxygène...
-
LACTIDES
- Écrit par Dina SURDIN
- 157 mots
Famille d'esters qui sont formés par condensation interne et cyclisation, avec élimination d'eau, de deux molécules d'un α-hydroxyacide ou de son anhydride. Les lactides ont pour formule générale :

Le premier composé de cette série est le lactide proprement dit, soit diméthyl-3,6-para-dioxane-2,5-dione,...
-
LACTONES ou OLIDES
- Écrit par Dina SURDIN
- 366 mots
Appelées aussi olides, les lactones sont des composés cycliques formés par l'estérification intramoléculaire d'un acide hydroxylé hydroxyacide, avec élimination d'eau. On peut donc les considérer comme des esters cycliques. Pour la nomenclature de ces composés, on ajoute le...
-
LE BEL JOSEPH ACHILLE (1847-1930)
- Écrit par Dina SURDIN
- 232 mots
Chimiste français, né à Pechelbronn (Bas-Rhin) et mort à Paris. Après des études à l'École polytechnique de Paris, Joseph Achille Le Bel devient préparateur à l'université de Strasbourg. Il est ensuite l'assistant d'Antoine Balard, puis de Charles Wurtz ; auprès de ce dernier, il a ...
-
MÉTHANE
- Écrit par Dina SURDIN
- 462 mots
Formule brute : CH4
Masse moléculaire : 16,04 g
Masse spécifique : 0,716 8 g/l
Point d'ébullition : — 161,5 0C
Point de fusion : — 184 0C
Le méthane est un hydrocarbure saturé, le plus simple des alcanes. C'est un gaz incolore, d'odeur légèrement alliacée, qui a été découvert...
-
NAPHTALÈNE
- Écrit par Dina SURDIN
- 422 mots
Masse moléculaire : 128,16 g
Masse spécifique : 1,145 g/cm3
Point de fusion : 80,22 0C
Point d'ébullition : 217,9 0C
Prismes monocliniques à odeur caractéristique.
Le naphtalène, de formule brute C10H8, est le plus simple des hydrocarbures aromatiques benzénoïdes polycycliques à noyaux...
-
NATTA GIULIO (1903-1979)
- Écrit par Dina SURDIN
- 239 mots
Chimiste italien né à Imperia, près de Gênes, et mort à Bergame. Après avoir fait des études d'ingénieur chimiste à l'institut polytechnique de Milan, Giulio Natta enseigne la chimie physique, générale et industrielle dans plusieurs universités (Pavie, Rome, Turin). En 1938, il revient à Milan,...
-
NICKEL CARBONYLE
- Écrit par Dina SURDIN
- 395 mots
Formule brute : Ni(CO)4
Masse moléculaire : 170,73 g
Masse spécifique : 1,32 g/cm3
Point de fusion : — 25 0C
Point d'ébullition : 43 0C
Liquide incolore, volatil et inflammable, le nickel carbonyle est peu soluble dans l'eau, très soluble dans l'éthanol, le benzène, l'éther, le chloroforme....
-
NICKEL DE RANEY
- Écrit par Dina SURDIN
- 201 mots
Catalyseur très actif, le plus couramment utilisé dans les réactions d'hydrogénation, notamment en chimie organique.
On l'obtient par dissolution de l'aluminium dans l'alliage de Raney (30 p. 100 de nickel, 70 p. 100 d'aluminium). L'action de la soude sur cet alliage en poudre...
-
NICKEL DE SABATIER-SENDERENS
- Écrit par Dina SURDIN
- 141 mots
Catalyseur le plus anciennement utilisé depuis Sabatier et Senderens dans de nombreuses réactions, en particulier dans les réactions d'hydrogénation. On l'obtient en réduisant l'oxyde ou l'hydroxyde de nickel pur par l'action de l'hydrogène à basse température (300-350 ...
-
NITRATE D'ARGENT AMMONIACAL
- Écrit par Dina SURDIN
- 168 mots
Solution de nitrate d'argent dans l'ammoniaque diluée. On utilise généralement le réactif de Tollens : à un mélange de solutions diluées de nitrate d'argent et d'hydroxyde d'argent on ajoute la quantité d'ammoniaque diluée juste suffisante pour dissoudre le précipité d'oxyde d'argent précédemment...
-
OSTWALD WILHELM (1853-1932)
- Écrit par Dina SURDIN
- 286 mots
- 1 média
Physico-chimiste allemand, né à Riga (Lettonie) et mort à Grossbothen, près de Leipzig. Wilhelm Ostwald entre en 1871 à l'université de Dorpat (Estonie) et obtient son diplôme en 1875. La même année, il devient assistant en physique à Dorpat ; il garde ce poste jusqu'en 1881, date à laquelle il...
-
OXÉTANNE
- Écrit par Dina SURDIN
- 70 mots
Époxy-1,3-propane

Masse moléculaire : 58,08 g
Masse spécifique : 0,893 g/cm3
Point d'ébullition : 47,5 0C
Huile d'odeur agréable, miscible à l'eau.
L'oxétanne réagit avec les organomagnésiens et les organolithiens pour donner, après hydrolyse, des propanols substitués en position...
-
OXIRANNE ou OXYDE D'ÉTHYLÈNE
- Écrit par Dina SURDIN
- 254 mots
Époxy-1,2-éthane ou oxyde d'éthylène.

Masse moléculaire : 44,05 g
Masse spécifique : 1,965 g/l
Point de fusion : — 111,3 0C
Point d'ébullition : 10,7 0C
Liquide ou gaz incolore.
Miscible à l'eau, l'éthanol, l'éther.
L'oxiranne, par la tension de son cycle à trois...
-
OXOLANES
- Écrit par Dina SURDIN
- 62 mots
Composés hétérocycliques à cinq chaînons, comportant un atome d'oxygène. On peut donc les considérer comme des éthers cycliques. L'exemple le plus simple en est le tétrahydrofuranne.
De la même manière, les dioxolanes comportent deux atomes d'oxygène dans un cycle à cinq chaînons...
-
PIPÉRIDINE
- Écrit par Dina SURDIN
- 171 mots
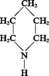
Masse moléculaire : 85,15 g
Masse volumique : 0,8622 g/cm3.
Point de fusion : — 7 0C (solidification de — 13 à — 17 0C)
Point d'ébullition : + 106,5 0C
Liquide incolore, d'odeur caractéristique, savonneux au toucher. Miscible à l'eau, l'alcool, l'éther ; soluble dans le...
-
PYRIDIQUES BASES
- Écrit par Dina SURDIN
- 188 mots
Homologues de la pyridine ; on connaît les picolines, ou méthylpyridines, de formule brute C6H7N ; les lutidines, de formule brute C7H9N (diméthylpyridines et éthylpyridines) ; les collidines, de formule brute C8H11N (triméthylpyridines, propylpyridines, méthyléthylpyridines).
L'α-picoline...
-
PYRIDONES
- Écrit par Dina SURDIN
- 89 mots
Groupe de cétones hétérocycliques dérivées de la pyridine.
Formule brute : C5H5ON
Masse moléculaire : 95,1 g
La pyride-2-one (ou hydroxy-2-pyridine) présente des réactions qui peuvent être reliées à l'une ou l'autre des formes mésomères (c'est pourquoi on l'appelle indifféremment énol ou cétone)...
-
PYROGALLOL
- Écrit par Dina SURDIN
- 254 mots
Trihydroxy-1,2,3-benzène, improprement dit acide pyrogallique.
Formule brute : C6H3(OH)3
Masse moléculaire : 126,11 g
Masse spécifique : 1,453 g/cm3
Point de fusion : 131-133 0C
Point d'ébullition : 309 0C
Composé inodore, cristallisant en aiguilles ou en feuilles blanches. Soluble dans l'eau,...
-
RANEY MÉTAUX DE
- Écrit par Dina SURDIN
- 61 mots
Famille de catalyseurs, généralement utilisés pour l'hydrogénation des composés organiques. Le plus utilisé est le nickel de Raney, dont les possibilités ont été largement étudiées. Il existe aussi le cobalt, le fer et le cuivre de Raney. On les obtient par dissolution de l'aluminium dans...
-
REPPE WALTER (1892-1969)
- Écrit par Dina SURDIN
- 402 mots
Chimiste allemand, né à Goringen, Walter Reppe est le fondateur d'une branche de la chimie dite « chimie de Reppe » (synthèses à partir de l'acétylène). Après des études couronnées en 1920 par une thèse de doctorat ès sciences soutenue à l'université de Munich, il entre au laboratoire central...
-
RÉSORCINOL
- Écrit par Dina SURDIN
- 291 mots

Masse moléculaire : 110,11 g
Masse spécifique : 1,285 g/cm3
Point de fusion : 110 0C
Point d'ébullition : 276,5 0C
Le résorcinol, ou résorcine, est un benzène-1,3-diol. Il cristallise en prismes ou en tables rhombiques. Il est soluble dans l'eau, l'éthanol, l'éther ; insoluble dans le sulfure...
- 1
- 2



