HYDROGÈNE
L'hydrogène est un gaz inodore et incolore ; c'est le plus léger de tous les éléments chimiques. Son numéro atomique est égal à 1. Il perd son électron unique dans ses combinaisons avec les éléments non-métalliques ; il s'unit également avec les métaux pour donner des hydrures dans lesquels il peut jouer le rôle d'anion (H-). Enfin les composés les plus nombreux et notamment tous les composés organiques hydrogénés sont des composés covalents.
L'hydrogène est probablement l'élément le plus abondant de l'univers, mais il ne représente que 0,9 p. 100 en poids de la croûte terrestre en raison de la faiblesse de l'attraction de la Terre par rapport à d'autres astres.
La concentration de l'hydrogène dans l'atmosphère jusqu'à une altitude de 80 kilomètres (troposphère et stratosphère) est sensiblement constante (10-5) ; elle augmente considérablement dans l'exosphère.
Isotopes et formes allotropiques
Trois isotopes sont connus. L'hydrogène (symbole H) léger, dont le noyau est formé uniquement d'un proton, est de loin le plus répandu. Le deutérium (symbole D), dont le noyau contient également un neutron, n'existe qu'à un taux de 0,015 p. 100 dans l'hydrogène naturel. Le tritium (symbole T), dont le noyau contient un second neutron, est un isotope artificiel.
Le deutérium est obtenu à partir de l' eau lourde D2O, elle-même préparée par électrolyses successives de solutions aqueuses (l'électrolyse favorise le départ de l'hydrogène H2, donc l'enrichissement en D2O). Alors que pour les éléments plus lourds les propriétés physiques des isotopes et de leurs composés sont très voisines et les propriétés chimiques indiscernables, il n'en est pas de même pour H et D grâce à un rapport des masses atomiques sensiblement égal à 2. L'eau lourde bout à 101,4 0C et se solidifie à 3,8 0C, sa masse volumique à 25 0C est 1,1046 g ( cm-3 au lieu de 0,9970 g . cm-3 pour l'eau ordinaire. La molécule de deutérium, dont l'énergie de vibration à 0 K est inférieure d'un facteur √2 à celle de l'hydrogène, possède une énergie de dissociation de 439,5 kJ . mole-1 à cette température, au lieu de 431,9 kJ . mole-1 pour H2. Il en résulte une plus faible réactivité chimique pour D2. Ce résultat peut être étendu aux liaisons C − D et C − H : la bromuration de l'acétone est environ sept fois plus lente dans le premier cas que dans le second. Le deutérium est utilisé pour marquer des groupements privilégiés en spectroscopie ou en cinétique organiques et les identifier ultérieurement.
Le tritium est généralement obtenu par bombardement neutronique du 6Li :

Il se désintègre, avec une période relativement courte (12,4 ans), en donnant une émission β.
Les isotopes lourds de l'hydrogène sont les principaux constituants des réactions de fusion au sein de la bombe H :
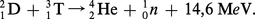
Une réaction analogue peut être obtenue sans passage par le tritium par bombardement aux neutrons du deutériure de lithium.
Les réactions de fusion mettent en jeu des énergies considérables, mille fois supérieures environ aux réactions de fission. Mais elles ne sont possibles que lorsque les noyaux ont franchi la barrière de potentiel qui les sépare ; ce franchissement exige pour le moment l'explosion préalable d'une bombe à 235U.
Les molécules d'hydrogène existent sous deux formes allotropiques : l'hydrogène ortho, dans lequel les spins des noyaux sont parallèles, et l'hydrogène para, où ils sont antiparallèles. À température élevée, la proportion d'ortho-hydrogène est de 75 p. 100, elle diminue graduellement avec la température. La transformation est totale à l'état liquide, mais elle exige un certain temps : comme elle est exothermique, elle pose des problèmes de conservation pour l'hydrogène liquide[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Paul HAGENMULLER : professeur à la faculté des sciences de Bordeaux, directeur du Laboratoire de chimie du solide au C.N.R.S.
Classification
Médias
Autres références
-
DÉCOUVERTE DE L'HYDROGÈNE PAR CAVENDISH
- Écrit par Bernard PIRE
- 728 mots
L’article envoyé en mai 1766 par l’honorable Henry Cavendish (1731-1810) à la Royal Society, dont il est membre, décrit de façon magistrale la découverte d’un gaz léger s’échappant de certaines réactions chimiques : l’hydrogène. Ces travaux, publiés dans la livraison datée du 1...
-
ACIDO-BASIQUE ÉQUILIBRE
- Écrit par Pierre KAMOUN
- 2 955 mots
- 1 média
L'apport alimentaire en ions hydrogène H+ est essentiellement représenté par les amino-acides introduits par les protéines (10 g de protéines libèrent 6 à 7 milliéquivalents d'ions H+). -
AMMONIAC
- Écrit par Henri GUÉRIN
- 5 033 mots
- 5 médias
L'action des sels d'ammonium sur les métaux dans l'ammoniac liquide est semblable à celle des acides en phase aqueuse : on obtient un sel du métal attaqué et un dégagement d'hydrogène :
-
ARCHÉES ASGARD
- Écrit par Patrick FORTERRE
- 3 785 mots
- 3 médias
...avec une bactérie sulfato-réductrice du genre Desulfovibrio et une archée productrice du méthane du genre Methanogenium. L’archée Loki produit de l’hydrogène qui est utilisé par la bactérie pour produire du sulfure d’hydrogène et par Methanogenium pour produire du méthane. Hiroyuki Imachi... -
ASTROCHIMIE
- Écrit par David FOSSÉ et Maryvonne GERIN
- 4 388 mots
- 3 médias
- Afficher les 59 références








