BENZÉNOÏDES
L' adjectif substantivé « benzénoïde » désigne cette importante famille de composés de la chimie organique qui renferment, dans leur squelette carboné, l'enchaînement du noyau benzénique. Mono ou polycycliques, porteurs ou non de groupements fonctionnels hétéroatomiques ou de chaînes latérales aliphatiques ou alicycliques, les composés benzénoïdes présentent, en commun, un ensemble de propriétés spécifiques qu'ils doivent à l'existence, dans leur structure, d'un système électronique π particulièrement stable, et dont le benzène offre l'exemple le plus simple. L'ensemble de ces propriétés est lié à la notion d' aromaticité.
La réactivité chimique particulière des composés benzénoïdes est caractérisée par la tendance de leur système électronique π à se reformer lorsque, dans une première phase de la réaction, il a été perturbé par l'attaque d'un réactif. Une conséquence de cette stabilité remarquable du système électronique π est que les composés benzénoïdes entrent normalement dans des réactions de substitution, alors que les composés, insaturés comme eux, mais non benzénoïdes, subissent de préférence des réactions d'addition. L'addition elle-même revêt, en série benzénoïde, un aspect particulier.
Qu'ils soient extraits des produits de la pyrogénation des charbons ou qu'ils résultent de traitements thermiques et catalytiques des pétroles, les hydrocarbures benzénoïdes jouent un rôle fondamental dans l'économie moderne : par la rigidité et la stabilité de leur structure, ils interviennent dans l'élaboration de fibres textiles synthétiques, de polymères et d'élastomères présentant de remarquables qualités mécaniques et thermiques ; par la facile excitation de leur système électronique π, ils constituent les matières premières de choix de l'industrie des colorants synthétiques ; par la facilité avec laquelle ils peuvent être substitués, ils sont utilisés dans la fabrication des détergents, des pesticides et de nombreux produits pharmaceutiques. Certains d'entre eux sont enfin d'excellents solvants.
Généralités
Les composés benzénoïdes renferment dans leur molécule un ou plusieurs cycles benzéniques. Ils appartiennent à la classe des squelettes dits alternants et présentent l'ensemble des caractères liés à l'aromaticité.
On distingue les hydrocarbures benzénoïdes dérivés du benzène par un remplacement d'un ou de plusieurs atomes d'hydrogène par autant de chaînes hydrocarbonées et les dérivés fonctionnels de ces hydrocarbures, dans la structure desquels interviennent un ou plusieurs hétéroatomes (halogènes, oxygène, soufre, azote...).
Les squelettes fondamentaux des hydrocarbures benzénoïdes peuvent être divisés en deux catégories :
– le benzène et ses homologues mono ou polycycliques à noyaux séparés (dont les cycles ne possèdent aucun atome en commun) ;
– les hydrocarbures polycycliques à noyaux condensés, dont les cycles possèdent en commun deux atomes de carbone adjacents.
Nomenclature. Isomérie
La plupart des hydrocarbures benzénoïdes sont désignés par des noms courants également utilisés dans la nomenclature de leurs dérivés fonctionnels. Certains de ces derniers portent des noms courants, dont quelques-uns sont indiqués dans le tableau.
Lorsqu'il intervient comme substituant par l'un de ses sommets, le noyau benzénique est désigné par le préfixe phényle, le noyau naphtalénique par le préfixe naphtyle (α ou β). Lorsque deux des sommets sont engagés dans la substitution, ces préfixes deviennent phénylène ou naphtylène.
L' isomérie de position des dérivés disubstitués du benzène se traduit, dans leur nomenclature, par les préfixes ortho- (-1,2), méta- (-1,3) ou para- (-1,4) ; dans le cas du naphtalène, les substitutions[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. BENZÉNOÏDES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Médias
Autres références
-
ANTHRACÈNE
- Écrit par Dina SURDIN
- 233 mots
Formule brute : C14H10
Masse moléculaire : 178,22 g
Masse spécifique : 1,25 g/cm3
Point de fusion : 217 0C
Point d'ébullition : 354-355 0C.
Cet hydrocarbure cyclique cristallise en prismes monocliniques incolores et présente une fluorescence violette quand il est absolument pur.
L'énergie...
-
AROMATICITÉ
- Écrit par André JULG
- 4 706 mots
- 2 médias
Considérons d'abord les hydrocarbures. Deux cas se présentent :ou bien la molécule ne contient que des cycles pairs (hydrocarbures benzénoïdes), ou bien elle possède au moins un cycle impair (fulvène, azulène et molécules dérivées : benzofulvène, benzoazulène...). Dans les premières molécules,... -
ASTROCHIMIE
- Écrit par David FOSSÉ et Maryvonne GERIN
- 4 388 mots
- 3 médias
...de carbone, et l'on pense qu'ensemble elles recèlent de 10 à 20 p. 100 du carbone cosmique. Pourtant, aucune n'a jamais été spécifiquement identifiée. C'est pour expliquer la présence de bandes caractéristiques dans le spectre infrarouge de nombreuses nébuleuses que les astronomes ont en effet imaginé... -
BENZÈNE
- Écrit par Dina SURDIN
- 477 mots
Le plus simple des hydrocarbures aromatiques.
Formule : C6H6
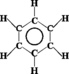
Fréquemment symbolisé par :
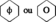
Masse moléculaire : 78,11 g
Masse spécifique : 0,88 g/cm3
Point de fusion : 5,5 0C
Point d'ébullition : 80,09 0C.
Cristaux incolores dans le système orthorhombique bipyramidal. Forme un azéotrope...
- Afficher les 11 références






