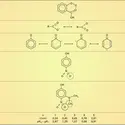
AMMONIUM ION
L'ion ammonium, NH+4, présente des propriétés basiques et peut être comparé aux ions des métaux alcalins. L'ion ammonium se combine à l'oxhydrile OH— pour donner l'ammoniaque NH4OH.
Le chlorure d'ammonium, NH4Cl, est employé dans les piles sèches comme électrolyte. Le sulfate d'ammonium, (NH4)2SO4, est employé comme engrais ; le nitrate d'ammonium, NH4NO3, est utilisé comme explosif et comme engrais.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Dina SURDIN : auteur
Classification
Pour citer cet article
Dina SURDIN. AMMONIUM ION [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER, Pierre SOUCHAY
- 12 364 mots
- 7 médias
Tous les acides plus forts que l'ion ammonium NH4+ sont ici des acides forts (cf. H3O+ dans l'eau) ; les amidures NH2— sont les analogues des hydroxydes dans l'eau. La réaction typique de neutralisation, est, ici,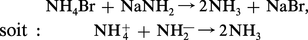
-
AMMONIAC
- Écrit par Henri GUÉRIN
- 5 033 mots
- 5 médias
La comparaison avec l'auto-ionisation de l'eau pure est immédiate et on considérera respectivement, comme acides et comme bases, des produits qui, au sein de l'ammoniac, libéreront respectivement NH4+ et NH2— au lieu de H+ et OH—. -
SOLS - Physico-chimie
- Écrit par Robert BLANCHET
- 1 548 mots
- 1 média
...conséquences agronomiques sont comparables, interviennent à l'égard de certains cations : il s'agit de la rétrogradation et de la libération du potassium et de l'ammonium, qui sont susceptibles d'être fixés dans le réseau cristallin de certains argiles (illites, vermiculites) ou d'en être libérés par suite de... -
SUPRAMOLÉCULAIRE (CHIMIE)
- Écrit par Jean-Marie LEHN
- 9 079 mots
- 12 médias
Les polyéthers et les azapolyéthers fixent sélectivement les ions ammonium primaires en ancrant le groupe −NH3+ dans la cavité circulaire par trois liaisons hydrogène +N−H...X (X = O, N). Vu le rôle de tels substrats en chimie et en biologie, nous avons cherché un dérivé qui donnerait des complexes...
Voir aussi