NITRIQUE ACIDE
L' acide nitrique est industriellement le plus important des dérivés oxygénés de l' azote. Il tient une place de premier plan dans l'industrie des engrais (nitrate d'ammonium en particulier), son rôle demeure considérable dans le domaine des explosifs (poudre noire, T.N.T., mélinite) et ses implications en industrie organique sont multiples (parfums artificiels, industrie de l'aniline, etc.).
Préparation industrielle de l'acide nitrique
L'industrie de l'acide nitrique est aujourd'hui couplée de façon pratiquement constante avec celle de l' ammoniac.
Les anciens procédés utilisant le nitrate du Chili ont en effet disparu presque totalement en Europe au profit de l' oxydation catalytique de l'ammoniac. Leur importance mondiale ne cesse de décroître. Ils sont fondés sur le déplacement à chaud de l'acide nitrique volatil au moyen de l'acide sulfurique, qui l'est beaucoup moins ( système Valentiner).
En raison de leur grande solubilité, les nitrates ne se rencontrent pas fréquemment dans la nature. Il existe cependant un important gisement de nitrate de sodium sur les hauts plateaux désertiques et secs de l'Amérique du Sud. Ce nitrate, appelé nitrate du Chili, a été et demeure la matière première de tous les procédés par déplacement.
Connu parfois sous le nom de procédé Ostwald, le procédé d'oxydation catalytique de l'ammoniac prend appui sur une observation de Frédéric Kuhlmann faite en 1838. Il comporte trois étapes successives : combustion catalytique de NH3, oxydation à nouveau de l'oxyde azotique NO obtenu, ce qui conduit au peroxyde NO2, et enfin absorption de ce dernier par l'eau. Le schéma réactionnel est le suivant :
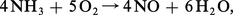

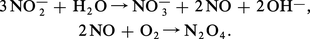
On obtient finalement une solution aqueuse contenant environ 50 p. 100 d'acide nitrique (35 degrés Baumé).
Le catalyseur utilisé a été d'abord un alliage platine-rhodium. En raison de son prix élevé, il est progressivement remplacé par un catalyseur, mis au point par la Badische Anilin, à base d'oxyde Fe2O3 activé par des oxydes de chrome et de bismuth. On l'utilise en couche uniforme de 5 à 6 centimètres d'épaisseur dans les fours de combustion en brique réfractaire mesurant environ 6 mètres de diamètre. La réaction commence lorsque la température atteint 250 0C. Comme elle est exothermique, cette température s'élève rapidement. Un équilibre de marche est atteint vers 600-700 0C. Il faut éviter un échauffement excessif susceptible de mener, à 900 0C par exemple, à une combustion de NH3 avec mise en liberté d'azote.
La production mondiale d'acide nitrique est d'environ 60 millions de tonnes par an.
L'obtention de l'acide pur est possible à partir des solutions industrielles à 50-60 p. 100. Par distillation de ces solutions, on obtient d'abord à 121,9 0C le mélange azéotropique, qui est à 68,4 p. 100 en HNO3 (fig. 1). Une nouvelle distillation en présence d'acide sulfurique concentré mène à une solution à 98 p. 100 en acide nitrique. L'acide absolu HNO3 a été isolé par cristallisation à — 42 0C à partir de la solution précédente.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean ROUXEL : professeur à l'université de Nantes
Classification
Pour citer cet article
Jean ROUXEL. NITRIQUE ACIDE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 10/02/2009
Médias
Autres références
-
AMMONIAC
- Écrit par Henri GUÉRIN
- 5 033 mots
- 5 médias
En présence d'une toile de platine portée à 700-800 0C l'azote passe au degré + 2 en formant du monoxyde d'azote (oxyde azotique). C'est la réaction de base de la synthèse de l'acide nitrique :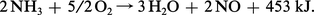
-
ATMOSPHÈRE - Chimie
- Écrit par Marcel NICOLET
- 3 553 mots
- 5 médias
La concentration de NO et de NO2 dans la stratosphère résultant d'une production continuelle à partir de N2O (équation 13a) est cependant limitée par d'autres réactions. Nous retiendrons surtout celle qui donne lieu à la formation de l'acide nitrique par le mécanisme :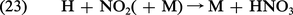
-
CYCLES BIOGÉOCHIMIQUES
- Écrit par Jean-Claude DUPLESSY
- 7 878 mots
- 6 médias
– L'acide nitrique, HNO3, résulte de l'oxydation naturelle des oxydes d'azote. Il est produit industriellement, car les nitrates servent à fabriquer des engrais et des explosifs. -
EAU RÉGALE
- Écrit par Dina SURDIN
- 223 mots
Mélange de deux ou trois volumes d'acide chlorhydrique concentré et d'un volume d'acide nitrique concentré. Les alchimistes ont appelé ce mélange « eau régale » (c'est-à-dire royale) pour ses propriétés : il dissout en effet l'or et d'autres métaux dits nobles....
- Afficher les 8 références







