CARBONE
Le carbone est l'élément chimique non métallique de symbole C et de numéro atomique 6. Il est présent dans de nombreux composés naturels : gaz carbonique de l'atmosphère, roches calcaires, combustibles (gaz, pétrole, charbons minéraux). C'est de plus un constituant fondamental de la matière vivante. Par la photosynthèse, les plantes convertissent le gaz carbonique de l'air en hydrates de carbone, lesquels sont dégradés en gaz carbonique par les êtres vivants. Cette chaîne fermée constitue le cycle du carbone.
Le carbone est le quatorzième des éléments de la surface de la Terre classés par ordre d'abondance décroissante. Il constitue environ 0,9 p. 100 en masse de la lithosphère et de l'hydrosphère réunies. Certains échantillons, graphite et diamant, existent à l'état naturel sous forme cristallisée et dans un très grand état de pureté.
La grande majorité des composés du carbone relèvent de la chimie organique ; seuls seront examinés dans cet article des composés minéraux : oxydes et leurs dérivés, carbures métalliques et composés d'insertion, composés azotés.
L'élément et le corps simple
L'atome
Il résulte de son numéro atomique que le cortège électronique de l'atome de carbone correspond, dans son minimum d'énergie, au symbolisme : 1s2, 2s2, 2p2, c'est-à-dire que la couche la plus profonde des électrons (couche K) est complète avec deux électrons et que quatre électrons sont sur la couche externe L. Deux de ces électrons occupent l'orbitale 2s, les deux autres occupant chacun une orbitale différente parmi les trois orbitales 2p disponibles.
Le noyau contient toujours six protons mais le nombre de neutrons associés est variable : le carbone possède deux isotopes stables et cinq radio-isotopes. Seul le radio-isotope de nombre de masse 14 existe dans la couche superficielle de la Terre par suite, d'une part, de sa longue période et, d'autre part, de sa formation dans l'atmosphère par action de la composante neutronique du rayonnement cosmique sur l'azote. Cette réaction nucléaire se traduit par le symbole : 147N (n, p) 146C. Cet isotope radioactif du carbone a permis de déterminer l'âge de fossiles divers provenant de substances vivantes. Pour ce faire, on admet que l'intensité du rayonnement cosmique est restée constante du moins pendant un temps égal à plusieurs périodes τ de cet isotope (τ = 5 700 ans) ; on admet encore que les êtres vivants ne réalisent pas une fixation préférentielle de certains isotopes du carbone au cours de leur métabolisme ; aussi la concentration en radiocarbone devrait-elle se retrouver constante au cours des âges chez tous les êtres vivants. Cette concentration en radiocarbone ne peut se maintenir que si les échanges grâce au métabolisme avec le gaz carbonique de l'atmosphère ou toute autre source de carbone se poursuivent. Après la mort de l'animal ou de la plante, la teneur en radiocarbone diminue suivant la loi de désintégration radioactive du carbone 14. La radioactivité de l'isotope 14 du carbone correspond à la transmutation :
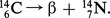
Les caractéristiques fondamentales de l'atome entraînent un rayon atomique faible et un potentiel de première ionisation moyennement élevé.
Il résulte des caractéristiques du cortège électronique que l'atome de carbone est un peu moins facilement ionisable que l'atome d'un quelconque des éléments de la même colonne de la classification périodique (silicium, germanium, étain et plomb) et que cet atome est plus petit que ceux des autres éléments de cette colonne.
Variétés allotropiques
À côté des deux formes cristallines, graphite et diamant, le carbone existe sous différentes formes amorphes qui peuvent être assez impures. Les propriétés physiques varient beaucoup selon la variété considérée. Leurs propriétés chimiques, les[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean AMIEL : ancien élève de l'École nationale supérieure de physique et de chimie de Paris, agrégé de physique, professeur honoraire de chimie générale à l'université de Paris-VI-Pierre-et-Marie-Curie
- Henry BRUSSET : docteur ès sciences, professeur honoraire de l'université de Paris-VI et de l'École centrale des arts et manufactures
Classification
Pour citer cet article
Jean AMIEL et Henry BRUSSET. CARBONE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER , Gérard FESSIER , Guy HENRY et Joëlle PONTET
- 14 176 mots
- 10 médias
Cette existence des deux variétés allotropiques du fer joue un grand rôle pour les propriétés de l'acier.Le fait essentiel réside dans la différence de solubilité du carbone dans chacune de ces formes. Alors que cette solubilité du carbone est nulle ou extrêmement faible dans le fer α, elle est... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
...aux plus gros efforts dans les trains d'atterrissage des avions (cf. acier – Technologie). L'acier le plus simple est un alliage de fer et de carbone, renfermant moins de 2 p. 100 en poids de carbone (9 atomes pour 100). Il faut rappeler que le carbone n'est pas lui-même un métal, mais que le... -
ASTROCHIMIE
- Écrit par David FOSSÉ et Maryvonne GERIN
- 4 388 mots
- 3 médias
...hydrocarbures simples subsistent malgré les conditions de rayonnement. On s'aperçoit donc que les chemins de la synthèse moléculaire dans l'espace sont variés. Il existe cependant un dénominateur commun aux espèces détectées dans le milieu interstellaire : elles contiennent pratiquement toutes du carbone. Comme... -
AUTOTROPHIE & HÉTÉROTROPHIE
- Écrit par Alexis MOYSE
- 2 503 mots
- 2 médias
Le carbone minéral assimilable étant sous la forme de gaz carbonique ou d'ions carbonate ou bicarbonate, l'autotrophie complète suppose la capacité de fixer ces substances et de les réduire, c'est-à-dire de passer du composé CO2 à des constituants dans lesquels les atomes de carbone,... - Afficher les 48 références







