CARBOXYLIQUES ACIDES
Structure et propriétés physiques
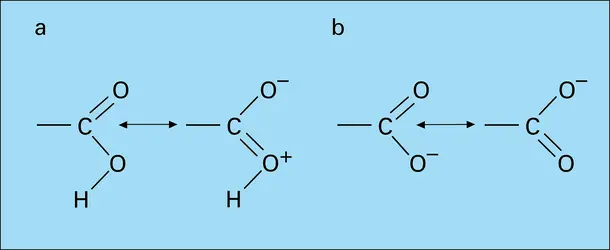
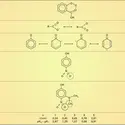
La structure électronique du groupe carboxylique est caractérisée par la conjugaison interne du système π, qui a pour conséquence une coplanéité des trois atomes du groupe CO2, tous trois hybrides sp2 (fig. 1). Dans l'ion carboxylate, —CO2–, deux doublets de symétrie p ou π sont partagés entre les trois atomes : ils sont décrits par une première orbitale moléculaire liante, de symétrie π et par une seconde non liante, antisymétrique par rapport au plan contenant les trois noyaux ainsi que par rapport au plan médiateur de la structure. Une troisième orbitale moléculaire, antiliante, inoccupée dans l'état fondamental (lowest unoccupied molecular orbital, L.U.M.O.), est disponible pour recevoir, en partage, un doublet apporté par un réactif nucléophile. Dans l'acide lui-même (—CO2H), les trois types d'atomes se partagent également deux doublets de symétrie p ou π ; la pondération des orbitales atomiques dans les trois orbitales moléculaires est un peu différente de celle de l'anion, mais la structure électronique est décrite d'une manière comparable.
À la structure de l'anion carboxylate, totalement symétrique, correspond une stabilisation, par conjugaison supérieure à celle de la molécule neutre d'acide dont la structure est dissymétrique. Une conséquence est que l'ion carboxylate, stabilisé par conjugaison et fortement solvaté par l'eau, présentera, dans les conditions habituelles, une concentration non négligeable et que la molécule carboxylique aura des propriétés acides. L'augmentation de la densité électronique π, au niveau de l'oxygène non protoné, confère en outre à ce site un caractère basique. Enfin, l'ensemble des propriétés acides et basiques du groupe fonctionnel est responsable d'une importante association intermoléculaire des acides carboxyliques par formation de liaisons hydrogène. Cette association, le plus souvent bimoléculaire (fig. 2), subsiste en partie à l'état gazeux et en solution diluée non dissociante. Elle modifie les températures de changement d'état solide/liquide et liquide/vapeur : l'acide formique bout à 103 0C et l'acide acétique à 117 0C. Comme dans le cadre des alcanes, on note une alternance des températures de fusion des chaînes paires et impaires.
L'acide acétique et l'acide propionique sont des solvants de miscibilité, à la fois aquosolubles et liposolubles. Les acides lourds sont nettement liposolubles, ils possèdent des propriétés amphiphiles. Les molécules de sels alcalins (savons) possèdent une extrémité polaire solvatée par l'eau et une longue chaîne carbonée qui ne l'est pas : en solution aqueuse, elles ont tendance à s'organiser en formant des structures ordonnées sphériques (micelles) au sein desquelles les chaînes non polaires se regroupent en minimisant leur énergie par des interactions de van der Waals tandis que les « têtes » ioniques forment, à l'extérieur de la micelle, une surface solvatée par l'eau. Lorsqu'on introduit un tel savon dans une suspension de gouttelettes d'huile dans de l'eau, les molécules amphiphiles s'organisent à l'interface eau-huile en plaçant leur « tête » hydrophile dans la phase aqueuse et leur « queue » lipophile dans la phase huile. Chaque gouttelette, initialement non miscible à l'eau, est ainsi transformée en une gouttelette dont la surface est devenue hydrophile, donc solvatée par l'eau. Tel est le principe, simplifié, de la « dissolution » des graisses par les savons.
La fonction carboxylique absorbe dans l'ultraviolet (vers 200 nm), à la limite d'utilisation des spectromètres usuels. Leur absorption dans l'infrarouge est caractérisée par une bande large νOH associée, dans la région de 3 000 cm–1 caractérisant[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. CARBOXYLIQUES ACIDES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 111 mots
- 3 médias
L'acide acétique, acide organique de formule CH3COOH, est le membre le plus important de la famille des acides carboxyliques. Il joue avec ses dérivés un rôle essentiel dans de nombreuses synthèses et dégradations biologiques accompagnant le métabolisme des aliments et la formation des tissus....
-
ACÉTYLACÉTIQUE ESTER
- Écrit par Jacques METZGER
- 1 355 mots
- 2 médias
L'acide acétylacétique est le nom usuel du butanone-3-oïque :
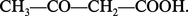
Cet acide a été isolé dans les urines pathologiques. Il peut être obtenu par une hydrolyse prudente de son ester éthylique. Ce dernier, beaucoup plus important, est un intermédiaire utilisé dans l'industrie pharmaceutique et dans...
-
ACIDES-ALCOOLS
- Écrit par Jacques METZGER
- 1 300 mots
- 1 média
Un acide-alcool est une molécule renfermant au moins une fonction acide carboxylique et une fonction alcool.
La nature nous en fournit de nombreux exemples : acides lactique du lait aigri, malique des pommes avant maturité (diacide-monoalcool), tartrique du tartre des vins (diacide-diacool), citrique...
-
ACIDES & BASES
- Écrit par Yves GAUTIER, Pierre SOUCHAY
- 12 364 mots
- 7 médias
Un acide carboxylique s'ionise en un anion mésomère (formule 2), si bien qu'en fait la charge négative est répartie entre les deux atomes d'oxygène, donnant une structure intermédiaire entre les précédentes (on dit qu'il y a résonance entre celles-ci). La structure réelle... - Afficher les 15 références
Voir aussi
- HYDROLYSE
- PEROXYDES
- PERKIN RÉACTION DE
- CARBONÉE CHAÎNE
- SOLUBILITÉ
- CHIMIQUES INDUSTRIES
- HÉTÉROLYSE
- PROPIONIQUE ACIDE
- OXYDATION
- AMPHIPHILE MOLÉCULE
- DÉSHYDRATATION
- GRAS ACIDES
- NUCLÉOPHILES SUBSTITUTIONS
- DÉCARBOXYLATION
- KOLBE RÉACTION DE
- ANHYDRIDES D'ACIDES CARBOXYLIQUES
- ANHYDRIDE ACÉTIQUE
- ANHYDRIDE PHTALIQUE
- ALCOOLYSE
- ÉLECTRONIQUE STRUCTURE
- CONJUGAISON, chimie
- NOMENCLATURE, chimie
- HALOGÉNURES