SOLVANTS
Un solvant est un liquide dans lequel on introduit une ou plusieurs substances – les solutés – de manière à constituer une phase homogène : la solution. Le solvant est donc défini non par sa structure chimique, mais par son état physique – l'état liquide – et par l'usage qui en est fait ; il existe ainsi une variété infinie de solvants : l'eau, les composés organiques simples et liquides à la température ambiante (alcools, acides, hydrocarbures, etc.) sont les plus classiques, mais des gaz condensés ou sous pression, comme l'ammoniac ou le dioxyde de carbone, et des sels fondus (par exemple la cryolithe, liquide à plus de 1 000 0C) sont également utilisés comme solvants.
Milieux réactionnels et agents d'extraction dans l'industrie, supports pour le transport et la mise en œuvre des peintures, encres, parfums, aérosols, agents de nettoyage, les solvants ont envahi toutes les activités ; ils sont, de ce fait, accusés de bien des pollutions. Cependant, un usage de plus en plus spécifique et mieux contrôlé, des opérations de recyclage les rendent de plus en plus discrets tout en élargissant leur rôle, pour longtemps encore indispensable.
Classification
Les propriétés physiques conduisent à une première distinction entre solvants moléculaires et solvants ionisés. Les composés organiques constituent, comme l'eau, des solvants moléculaires : ils sont constitués de molécules électriquement neutres et présentent, à l'état pur, une conductivité faible. Les solvants ionisés sont formés principalement d'anions et de cations reliés par des attractions électrostatiques et sont bons conducteurs : c'est le cas des sels fondus.
Les solvants moléculaires sont généralement classés à partir de la valeur de leur constante diélectrique (ε) et du moment dipolaire de leur molécule (μ) qui définissent à la fois la nature des espèces susceptibles de s'y dissoudre et les modes d'interaction soluté-solvant.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques DEVYNCK : directeur de recherche au C.N.R.S.
Classification
Pour citer cet article
Jacques DEVYNCK. SOLVANTS [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Média
Autres références
-
ACÉTONE
- Écrit par Roger GALLO
- 641 mots
Liquide volatil incolore, d'une odeur piquante, miscible avec l'eau, l'alcool, l'éther, le chloroforme et le benzène, l'acétone, ou diméthylcétone, ou propan-2-one, a pour formule brute C3H6O : un atome de carbone C est lié par des liaisons chimiques simples à deux...
-
ACÉTYLÈNE
- Écrit par Henri GUÉRIN
- 5 089 mots
- 6 médias
...l'extension, lorsque les travaux de Linde et de Claude eurent fourni la possibilité d'extraire facilement l'oxygène de l'air. La préparation de solvants chlorés : trichloréthylène et perchloréthylène, entreprise dès 1910 en Allemagne, ne devait surtout se développer en France et dans les autres... -
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
En raison de sa charge élevée par rapport à son volume, H+ n'existe pas comme tel en solution, mais se fixe sur le solvant (dénommé SH) qui se trouve jouer ainsi le rôle de base. Par conséquent, l'ionisation d'un acide dans l' eau ne s'écrira pas :mais :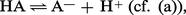 et la constante...
et la constante...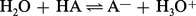
-
ALCOOL ÉTHYLIQUE ou ÉTHANOL
- Écrit par Fernand COUSSEMANT
- 694 mots
Alcool primaire, liquide incolore, d'odeur agréable, miscible à l'eau en toutes proportions, miscible à de nombreux solvants organiques, l'éthanol ou alcool éthylique, CH3—CH2OH, a les caractéristiques suivantes :
Masse moléculaire : 46,07 g
Masse spécifique : 0,789 3...
- Afficher les 45 références



