ACIDES & BASES
Un acide est un corps capable de céder un ou des protons (une particule fondamentale chargée d'électricité positive) et une base est un corps capable de capter un ou des protons. Chacun a ses caractéristiques. Les acides ont une saveur aigre (l'adjectif latin acidus signifie « aigre », « acide »), et les bases une saveur particulière comme celle de la lessive (le terme d'alcali, nom générique des bases, dérive de l'arabe al-kali, « cendre de plantes », d'où l'on retirait par lessivage du carbonate de potassium).
Les uns et les autres ont une action sur les « indicateurs colorés » : la solution aqueuse (présence d'eau) de tournesol vire au rouge au contact des acides et au bleu au contact des bases ; la solution d'hélianthine est rose en milieu acide et jaune en milieu basique, etc. Ainsi, les indicateurs colorés permettent d'identifier si une espèce est acide ou basique, en établissant une échelle fondée sur un paramètre appelé le pH (p pour potentiel et H pour hydrogène). Cette mesure de l'état d'une solution acidobasique contenant des ions H+ est : pH = — log[H+], où [H+]est la concentration en ions H+ (ou H3O+) et log le logarithme décimal. L'échelle va de pH = 0 (acides forts), pour les solutions à concentration élevée en ions H+ (ou H3O+), jusqu'à 14 pour les bases les plus fortes, c’est-à-dire pour les solutions à concentration élevée en ions OH—. Un pH égal à 7 correspond à une solution neutre. Par exemple, l’acide chlorhydrique concentré (acide fort) a un pH proche de 0 ; la soude, base très forte, a un pH proche de 14. Le pH a une grande importance dans de nombreux domaines.
Les notions d'acide et de base sont indissociables. En effet, tel Janus, la plupart des espèces chimiques en milieu aqueux possèdent un double visage et peuvent se dédoubler en acide et en base.
Le physicien et chimiste suédois Svante Arrhenius (1859-1927) fut le premier à proposer, en 1887, la théorie de l'ionisation des électrolytes pour interpréter les lois physiques de l'électrolyse, méthode qui permet de décomposer une espèce chimique en ions par l'action d'un courant électrique : les uns, porteurs de charge positive, comme l'ion hydrogène (H+) ou l'ion ammonium (NH4+), sont les cations ; les autres, de charge négative, comme l'ion hydroxyde (OH–) ou l'ion nitrique (NO3–), sont les anions. Le chimiste danois Johannes Brønsted proposa, vers 1922, une théorie de l'acidobasicité plus générale que celle d'Arrhenius, admise jusqu'alors. Sa définition des acides et des bases, qui perdure, peut se résumer ainsi :
acide → base + H+
Le couple acide-base le plus simple est celui de l'eau (H2O), mais comporte une singularité que nous allons développer. Nous appelons réaction d'autoprotolyse de l'eau la réaction suivante :
H2O + H2O → H3O+ + OH–
Dans cette réaction, les deux molécules qui réagissent jouent des rôles différents. En effet, une des deux molécules d'eau perd un proton pour donner un ion hydroxyde, selon le schéma :
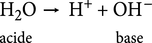
Une molécule d'eau H2O agit comme un acide dont la base conjuguée est l'ion hydroxyde OH—. Les deux espèces H2O et OH— forment le couple H2O /OH—.
L'autre molécule d'eau capte un ion hydronium H3O+, selon le schéma :
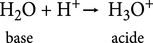
Dans cette « demi-équation protonique », la molécule d'eau H2O se comporte comme une base dont l'acide conjugué est l'ion hydronium. Les deux espèces H3O+ et OH— forment finalement le couple acidobasique H3O+ /OH—.
Bien d'autres exemples pourraient être cités. Voici celui de l'acide éthanoïque (CH3CO2H). Dans certaines conditions expérimentales, les molécules d'acide éthanoïque peuvent participer à une réaction chimique et donner naissance à des ions éthanoates (CH[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Yves GAUTIER
: docteur en sciences de la Terre, concepteur de la collection
La Science au présent à la demande et sous la direction d'Encyclopædia Universalis, rédacteur en chef de 1997 à 2015 - Pierre SOUCHAY : professeur à l'université de Paris-VI-Pierre-et-Marie Curie et à l'École nationale supérieure de chimie, Paris
Classification
Médias
Autres références
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 111 mots
- 3 médias
L'acide acétique, acide organique de formule CH3COOH, est le membre le plus important de la famille des acides carboxyliques. Il joue avec ses dérivés un rôle essentiel dans de nombreuses synthèses et dégradations biologiques accompagnant le métabolisme des aliments et la formation des tissus....
-
ACIDES-ALCOOLS
- Écrit par Jacques METZGER
- 1 300 mots
- 1 média
Un acide-alcool est une molécule renfermant au moins une fonction acide carboxylique et une fonction alcool.
La nature nous en fournit de nombreux exemples : acides lactique du lait aigri, malique des pommes avant maturité (diacide-monoalcool), tartrique du tartre des vins (diacide-diacool), citrique...
-
ALCOOLS
- Écrit par Jacques METZGER
- 5 832 mots
- 8 médias
Lafonction alcool présente à la fois un caractère acide et un caractère basique. Son acidité se manifeste lorsqu'il est mis au contact d'une base : le proton est cédé à cette dernière et l'anion alcoolate formé ainsi que l'acide conjugué de la base se trouvent en équilibre avec l'alcool non dissocié... -
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 350 mots
- 4 médias
Les principales méthodes de préparation des dérivés carbonylés mettant en œuvre la réduction du substrat concernent les acides et les fonctions dérivées. - Afficher les 40 références








