CARBOXYLIQUES ACIDES
- Article mis en ligne le
- Modifié le
- Écrit par Jacques METZGER
Anhydrides d'acides carboxyliques
Comme leur nom l'indique, les anhydrides d'acides carboxyliques dérivent des acides carboxyliques par perte d'eau. Leur formule, R—CO—O—CO—R, correspond à la déshydratation d'un couple d'acides identiques ; toutefois il existe des anhydrides mixtes résultant de la perte d'une molécule d'eau entre deux molécules d'acides carboxyliques différents R—CO—O—CO—R′, ou même entre un acide carboxylique et un oxacide minéral, comme l'anhydride acétonitrique CH3—CO—O—NO2. En outre, la déshydratation intramoléculaire de certains acides conduit à un anhydride interne appelé cétène, comme le diphénylcétène (C6H5)2C=C=O dérivé de l'acide diphénylacétique (C6H5)2CH—COOH.
Compte tenu de leur facile hydrolyse, les anhydrides n'existent pas à l'état naturel. Par contre, leur grande réactivité en fait des intermédiaires importants de la synthèse organique industrielle, notamment les anhydrides acétique et ortho-phtalique. Le premier est un agent d'acétylation très employé en chimie fine (pharmacie, pesticides, colorants), mais également en chimie plus lourde (fibres et films de triacétate de cellulose), le second intervient dans la fabrication de polyesters divers, bases de vernis, de plastifiants et de colorants.
Nomenclature
Le nom des anhydrides symétriques dérive de celui des acides correspondants en remplaçant le substantif acide par anhydride. Par exemple, anhydride acétique (CH3—CO)2O, anhydride propionique (C2H5—CO)2O.
Les anhydrides mixtes sont désignés comme anhydrides d'acide A et d'acide B, par exemple, anhydride d'acide benzoïque et d'acide acétique C6H5—CO—O—CO—CH3, anhydride sulfoacétique CH3—CO—O—SO3H.
Préparations et modes de formation
Une méthode générale de préparation, au laboratoire, des anhydrides symétriques consiste à déshydrater l'acide carboxylique correspondant. L' agent déshydratant le plus efficace est l'anhydride acétique, fabriqué industriellement par une autre voie ; en présence d'une quantité catalytique d'acide sulfurique, le mélange de deux molécules d'acide et d'une molécule d'anhydride acétique est chauffé à 120 0C : l'échange fonctionnel se produit et l'équilibre est déplacé par distillation de l'acide acétique formé, qui est le constituant le plus volatil du mélange réactionnel.
Une seconde méthode également générale fait réagir le chlorure de l'un des deux acides sur un sel alcalin de l'autre :

L'obtention d'un anhydride symétrique par cette méthode n'implique pas l'isolement du chlorure d'acide : on peut faire réagir, sur le carboxylate alcalin, un agent de chloruration comme l'oxychlorure de phosphore.
La fabrication industrielle de l'anhydride acétique met en œuvre deux matières premières différentes : l' acétaldéhyde et l'acide acétique.
– Préparation par oxydation de l'acétaldéhyde : ce composé est oxydé par l'air en présence d'un catalyseur constitué par un mélange d'acétates de cuivre et de cobalt.
– Préparation par déshydratation de l'acide acétique : en présence d'un catalyseur comme le phosphate triéthylique, ce composé est porté un temps très court à 700 0C ; il se produit une déshydratation de la molécule en cétène. Le processus étant réversible, le mélange réactionnel est brutalement refroidi à — 20 0C (trempe) : l'eau se sépare et le cétène est immédiatement absorbé par de l'acide acétique anhydride à 50 0C. Le rendement de cette synthèse est excellent (réaction 8 8a).
Le même procédé permet de préparer des anhydrides mixtes d'acide acétique et d'un autre acide par absorption, par ce dernier, du cétène formé au départ de l'acide acétique (réaction[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. CARBOXYLIQUES ACIDES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Médias
Autres références
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 111 mots
- 3 médias
L'acide acétique, acide organique de formule CH3COOH, est le membre le plus important de la famille des acides carboxyliques. Il joue avec ses dérivés un rôle essentiel dans de nombreuses synthèses et dégradations biologiques accompagnant le métabolisme des aliments et la formation des tissus....
-
ACÉTYLACÉTIQUE ESTER
- Écrit par Jacques METZGER
- 1 355 mots
- 2 médias
L'acide acétylacétique est le nom usuel du butanone-3-oïque :
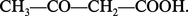
Cet acide a été isolé dans les urines pathologiques. Il peut être obtenu par une hydrolyse prudente de son ester éthylique. Ce dernier, beaucoup plus important, est un intermédiaire utilisé dans l'industrie pharmaceutique et dans...
-
ACIDES-ALCOOLS
- Écrit par Jacques METZGER
- 1 300 mots
- 1 média
Un acide-alcool est une molécule renfermant au moins une fonction acide carboxylique et une fonction alcool.
La nature nous en fournit de nombreux exemples : acides lactique du lait aigri, malique des pommes avant maturité (diacide-monoalcool), tartrique du tartre des vins (diacide-diacool), citrique...
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
Un acide carboxylique s'ionise en un anion mésomère (formule 2), si bien qu'en fait la charge négative est répartie entre les deux atomes d'oxygène, donnant une structure intermédiaire entre les précédentes (on dit qu'il y a résonance entre celles-ci). La structure réelle... - Afficher les 15 références










