ACÉTIQUE ACIDE
L'acide acétique, acide organique de formule CH3COOH, est le membre le plus important de la famille des acides carboxyliques. Il joue avec ses dérivés un rôle essentiel dans de nombreuses synthèses et dégradations biologiques accompagnant le métabolisme des aliments et la formation des tissus. On le trouve à l'état libre dans la sueur et le sang. Il est présent également à l'état libre dans la sève des plantes et sous forme d'esters dans les fruits et dans les huiles essentielles. Étape finale de la fermentation d'un grand nombre de produits agricoles, il est aussi préparé en très grandes quantités par l'industrie. Celle-ci l'utilise comme solvant et comme intermédiaire dans la préparation de matières synthétiques : fibres textiles, vernis, plastiques, produits pharmaceutiques.
En pharmacologie, on observe souvent un renforcement de l'activité après acétylation d'une molécule : la choline et l'acétylcholine, l'acide salicylique et l'acide acétylsalicylique (aspirine), la morphine et l'héroïne notamment.
Propriétés
Acétique vient du latin acetum, mot qui désignait chez les Romains le vinaigre, solution aqueuse diluée d'acide acétique. L'extraction et la purification du principe actif de ces solutions ont été tentées par de nombreux chimistes au cours des siècles. Il semble que ce soit J. T. Löwitz qui, à la fin du xviiie siècle, ait réussi, le premier, à isoler l'acide pur en combinant distillations et cristallisations fractionnées. C'est un liquide incolore, très mobile, dont l'odeur piquante rappelle celle du vinaigre. À la différence de l'acide à l'état impur, il cristallise très facilement lorsqu'il est refroidi. Ses cristaux ressemblent à ceux de la glace, d'où le nom d'acide acétique glacial encore couramment employé aujourd'hui et que lui donna Löwitz. La nomenclature internationale recommande l'usage du substantif éthanoïque.
Fonction acide
Le groupe fonctionnel de l'acide acétique est, comme celui de tous les acides carboxyliques, représenté par la réunion d'une fonction carbonyle (CO) et d'une fonction hydroxyle (OH) ; toutefois, la conjugaison interne de l'ensemble des deux atomes d'oxygène et de l'atome de carbone (formules mésomères 1) implique une polarisation négative de l'atome d'oxygène carbonylique et une polarisation positive de l'atome d'oxygène hydroxylique. De cette situation de la distribution électronique de ce groupement fonctionnel résulte que l'oxygène carbonylique présente un caractère basique et que le groupement hydroxyle présente un caractère acide.
Anhydre ou en solution dans des solvants non polaires (benzène, éther de pétrole), l'acide acétique ne manifeste pas ses propriétés acides : il ne décompose pas les carbonates et ne conduit pas le courant électrique. Par contre, en solution aqueuse, il se comporte comme un acide faible ; il est notablement dissocié (pKa = 4,75).
Ses solutions peuvent être titrées par la soude en présence de phénolphtaléine. Elles attaquent facilement le fer et le zinc en fournissant les acétates correspondants et de l'hydrogène :

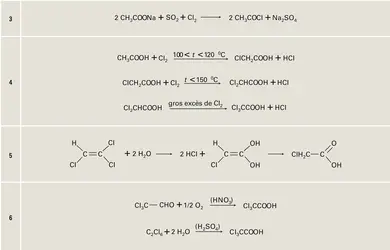
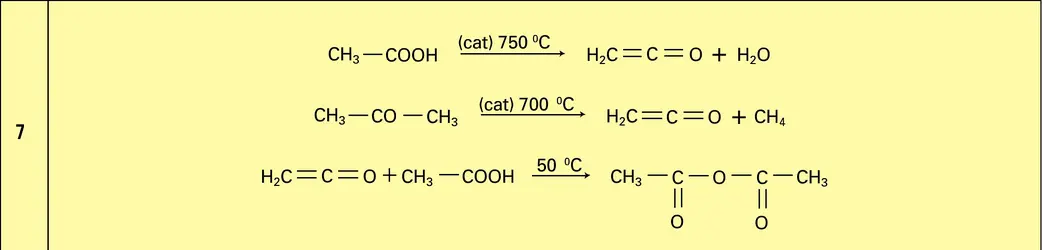
Comme tous les acides carboxyliques, l'éthanoïque réagit sur les alcools pour donner des esters (cf. 3 Applications). Il peut être transformé en chlorure d'acétyle par substitution du chlore au groupement hydroxyle à l'aide du tri- ou du pentachlorure de phosphore. Ce chlorure, beaucoup plus réactif que l'acide dont il dérive, est préparé, pour certains usages industriels, en faisant réagir un mélange équimoléculaire de chlore et de gaz sulfureux sur l'acétate de sodium sec (réaction 3).
C'est un liquide d'odeur suffocante qui fume à l'air.
Il est cependant moins employé que l'anhydride parce que[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. ACÉTIQUE ACIDE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACÉTYLÈNE
- Écrit par Henri GUÉRIN
- 5 089 mots
- 6 médias
...fabriqué à partir de l'acétylène, le perchlorétylène résulte principalement aujourd'hui de la chloration des mélanges propane-propène obtenus en raffinerie. L'acide acétique qui, par l'intermédiaire de l'aldéhyde acétique, a constitué le premier produit de synthèse à partir de l'acétylène, tend à être obtenu,... -
ACIDES & BASES
- Écrit par Yves GAUTIER, Pierre SOUCHAY
- 12 364 mots
- 7 médias
...mot « acide » vient du latin acidus (aigre), ce qui montre bien l'origine organoleptique de cette notion. Le vinaigre, solution aqueuse diluée d'acide acétique, issue de la fermentation du vin, semble trouver son origine quelque 3 000 ans avant notre ère, en Mésopotamie. Ce fut, pendant longtemps,... -
ALCOOL ÉTHYLIQUE ou ÉTHANOL
- Écrit par Fernand COUSSEMANT
- 694 mots
Alcool primaire, liquide incolore, d'odeur agréable, miscible à l'eau en toutes proportions, miscible à de nombreux solvants organiques, l'éthanol ou alcool éthylique, CH3—CH2OH, a les caractéristiques suivantes :
Masse moléculaire : 46,07 g
Masse spécifique : 0,789 3...
-
CARBOXYLIQUES ACIDES
- Écrit par Jacques METZGER
- 5 503 mots
- 6 médias
...diluée non dissociante. Elle modifie les températures de changement d'état solide/liquide et liquide/vapeur : l'acide formique bout à 103 0C et l'acideacétique à 117 0C. Comme dans le cadre des alcanes, on note une alternance des températures de fusion des chaînes paires et impaires. - Afficher les 9 références
Voir aussi