STÉROÏDES
Les stéroïdes forment une vaste famille chimique qui regroupe toutes les molécules naturelles dont le squelette carboné polycyclique s'apparente au gonane (perhydro-1,2-cyclopenténophénanthrène). Ils sont très répandus dans la nature où on les rencontre à tous les échelons du règne végétal et du règne animal.
Leur biosynthèse comporte une ou deux étapes principales. La première, par l'intermédiaire de l'acide mévalonique et du squalène, conduit aux stérols (alkyl-17 hydroxy-3-stéroïdes), les plus abondants des stéroïdes (quantité estimée sur le globe terrestre : environ 200 000 tonnes). Au cours d'une seconde étape, une partie de ceux-ci subit des transformations métaboliques fournissant des stéroïdes dont certains, notamment chez les mammifères, jouent un rôle biologique essentiel, en particulier hormonal. Cela permettra de distinguer les stéroïdes non hormonaux, comme les stérols, des stéroïdes hormonaux : hormones corticosurrénales et gonadiques, vitamines D, ecdystéroïdes et, dans l'un et l'autre cas, de dégager leurs propriétés les plus importantes et les principes généraux qui régissent leur biosynthèse et leur devenir.
Enfin, les nombreuses propriétés thérapeutiques des stéroïdes hormonaux et des molécules apparentées ont rendu nécessaire leur production industrielle. Celle-ci est effectuée essentiellement par synthèse chimique. Depuis plus de cinquante ans, l'industrie pharmaceutique les prépare soit par hémisynthèse à partir de stéroïdes naturels (stérols, acides biliaires, sapogénines), soit par synthèse totale.
Généralités
Le terme générique « stéroïde » rend compte des caractéristiques physico-chimiques des premiers représentants de cette famille, isolés de la fraction insaponifiable d'extraits lipidiques animaux. Il s'agissait, en effet, d'alcools secondaires se singularisant par leur état solide cristallisé et fondant à des températures supérieures à 100 0C. Le nom « stérol », formé du mot grec stéréos = solide et de la désinence – ol, spécifique des alcools, traduit ces propriétés. Le premier de ces composés fut isolé, vers 1770, de calculs biliaires, par Poulletier de la Salle, puis trouvé également, en 1815, dans les graisses animales, par M. E. Chevreul. Il fut nommé « cholestérine » (du grec kholé = bile et stéréos = solide) en souvenir de la source où il avait été découvert initialement. En 1859, M. Berthelot, prenant en considération la fonction alcool, modifia le nom en cholestérol. Depuis lors, de nombreux autres composés voisins ont été isolés.
À partir de 1936, le terme générique « stéroïde » est donné à tous les corps chimiques qui possèdent un noyau (gonane ; ) identique ou très proche de celui des stérols, alors que la dénomination « stérol » est réservée aux seuls hydroxy-3β stéroïdes porteurs d'une longue chaîne en 17 comme le cholestérol.
Structure stéréochimique
L' établissement de la structure des stéroïdes, avec sa stéréochimie précise, est l'aboutissement de recherches menées pendant plusieurs décennies. Les principales étapes furent la détermination, en 1888, par F. Reinitzer, de la formule brute du cholestérol, et sa confirmation vingt ans plus tard ; la proposition, dans les années 1920, par A. Windaus et H. Wieland, de structures développées planes approchées ; puis, grâce à l'application de la diffraction des rayons X, l'établissement de la structure stéréochimique définitive du noyau stéroïdique.
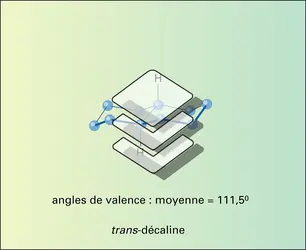
Le squelette de celui-ci, polycycle perhydropenténophénanthrénique, est constitué de dix-sept atomes de carbone formant trois cycles hexaniques dénommés A, B, C et un cycle pentanique D, accolés entre eux et pouvant adopter diverses conformations. Six atomes de carbone (C-5, C-8, C-9, C-10, C-13, C-14) sont des centres asymétriquement[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Dominique BIDET : docteur en pharmacie, ingénieur documentaliste au service de documentation biologique et pharmaco-chimique, Centre de recherche Roussel-Uclaf
- Jean-Cyr GAIGNAULT : docteur en pharmacie à l'université de Paris, docteur ès sciences physiques, membre de l'Académie nationale de pharmacie
- Jacques PERRONNET : ingénieur E.S.P.C.I., docteur ès sciences, attaché scientifique à l'Institut scientifique Roussel
- Daniel PHILIBERT : licencié ès sciences physiques, chef du service d'endocrinologie, Roussel-Uclaf
Classification
Pour citer cet article
Dominique BIDET, Jean-Cyr GAIGNAULT, Jacques PERRONNET et Daniel PHILIBERT. STÉROÏDES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALDOSTÉRONE
- Écrit par Pierre KAMOUN
- 1 641 mots
Dès 1934, Wintersteiner démontrait que l'animal, privé de surrénales, pouvait être maintenu en vie à l'aide d'une fraction amorphe extraite de la partie corticale de ces glandes.
En 1953, Wettstein et Reichstein ont isolé, à partir de cette fraction, une substance hormonale comportant...
-
ANABOLISANTS
- Écrit par Marie-Christine STÉRIN
- 160 mots
Non seulement les anabolisants accroissent le processus de construction des tissus vivants, ils sont aussi des substances susceptibles de modifier le métabolisme de ces derniers. Il s'agit essentiellement de dérivés des hormones mâles favorisant l'anabolisme protidique, ce qui se traduit...
-
ANDROGÈNES
- Écrit par Dominique BIDET, Jean-Cyr GAIGNAULT, Jacques PERRONNET
- 983 mots
-
ANTIHORMONES
- Écrit par Dominique BIDET, Jean-Cyr GAIGNAULT, Jacques PERRONNET
- 772 mots
La notion d'antihormone s'applique aujourd'hui aux molécules capables d'inhiber de façon compétitive la formation du complexe hormone-récepteur. Sa définition première, désignant toute substance capable de s'opposer aux effets résultant de l'action d'une hormone, a donc été restreinte....
- Afficher les 28 références
Voir aussi
- CIS CONFIGURATION
- TRANS CONFIGURATION
- CORTICOSURRÉNALES
- BILE
- BILIAIRES SELS
- TESTICULES
- TESTOSTÉRONE
- RÉCEPTEURS NUCLÉAIRES, biochimie
- PROGESTÉRONE
- LH (luteinizing hormone) ou HORMONE LUTÉINISANTE
- CALCUL BILIAIRE
- RELEASING FACTORS (RF)
- ACTH (adrenocorticotropic hormone) ou CORTICOTROPHINE
- FSH (Follicle Stimulating Hormone) ou HORMONE FOLLICULO-STIMULANTE
- ECDYSONE
- CORTISOL ou HYDROCORTISONE
- GLUCOCORTICOÏDES
- MINÉRALOCORTICOÏDES
- OVAIRE
- PLACENTA
- ESTRADIOL ou ŒSTRADIOL
- CORTISONE
- ESTRIOL ou ŒSTRIOL
- CORPS JAUNE
- CYCLIQUES COMPOSÉS
- CORTICOÏDES ou CORTICOSTÉROÏDES
- CHAISE CONFORMATION
- SAVONS
- SEXUELLES HORMONES
- SAPONINES
- MÉTABOLISME INTERMÉDIAIRE
- PHARMACIE & INDUSTRIE PHARMACEUTIQUE
- ANTI-INFLAMMATOIRES
- STÉROÏDES BIOSYNTHÈSE DES
- PHOSPHOLIPIDES
- LANOSTÉROL
- MÉVALONIQUE ACIDE
- CORTICOSTÉRONE
- CYCLOARTÉNOL
- DÉHYDROÉPIANDROSTÉRONE (DHEA)
- ANDROSTÈNEDIONE
- VITAMINE D3 ou CHOLÉCALCIFÉROL
- CHOLIQUE ACIDE
- CHOLESTANOL
- MUE
- COPROSTANOL
- ERGOSTÉROL
- STÉROLS
- PHYTOSTÉROLS
- SAPOGÉNINES
- STIGMASTÉROL
- VITAMINES D ou CALCIFÉROLS
- NOMENCLATURE, chimie
- DIFFÉRENCIATION SEXUELLE, biologie
- CHROMATINE
- BIOSYNTHÈSES
- FEEDBACK ou RÉTROACTION
- BILIAIRES ACIDES
- NYMPHE, zoologie
- PHARMACOCHIMIE
- RÉCEPTEURS HORMONAUX
- HÉMISYNTHÈSE
- RÉGULATIONS BIOCHIMIQUES
- CHÉNODÉOXYCHOLIQUE ACIDE
- MOLÉCULES BIOLOGIQUES, structure et fonction
- VIRILISATION
- CHOLESTÉRINE
- STANOL
- STÉNOL
- DÉCALINE
- SQUALÈNE
- ZOOSTÉROLS
- BÊTA-SITOSTÉROL
- HOPANE & HOPANOÏDES
- BIOHOPANOÏDES ou BACTÉRIOHOPANETÉTROLS
- GÉOHOPANOÏDES
- PRÉGNÉNOLONE
- VITAMINE D2 ou ERGOCALCIFÉROL
- ECDYSTÉROÏDES
- CRUSTECDYSONE
- DIOSGÉNINE
- ESTRONE ou ŒSTRONE
- DIHYDROERGOCALCIFÉROL
- DIHYDROTESTOSTÉRONE (DHT)