ATOME
L'atome est le terme ultime de la division de la matière dans lequel les éléments chimiques conservent leur individualité. C'est la plus petite particule d'un élément qui existe à l'état libre ou combiné. On connaît 90 éléments naturels auxquels s'ajoutent le technétium (Tc, Z = 43), le prométhéum (Pm, Z = 61) ainsi que les transuraniens obtenus artificiellement depuis 1940. Les corps simples sont exclusivement constitués d'atomes identiques ; les corps composés sont formés de la réunion d'atomes différents. On appelle molécules des groupements d'atomes caractéristiques de chaque espèce chimique.
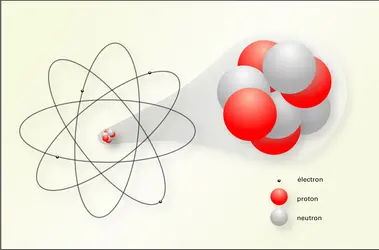
L'étymologie renvoie à l'idée assurée jusqu'à la fin du xixe siècle que les atomes sont indivisibles. Mais la physique moderne a révélé leur structure complexe à laquelle participent des particules infimes, protons et neutrons groupés dans un noyau, autour duquel se meuvent des électrons. Les dimensions du noyau sont de l'ordre de 10—12 cm, celles des atomes, avec leur cortège électronique, de l'ordre de 10—8 cm.
Deux atomes qui ont le même nombre de protons et d'électrons, mais qui diffèrent par leur nombre de neutrons, ont les mêmes propriétés chimiques, mais leurs propriétés nucléaires sont différentes. Ce sont des isotopes. Un élément préparé par voie chimique est, en général, un mélange d'isotopes qui ne peuvent pas être séparés par des réactions chimiques.
La stabilité d'un système atomique – molécule, atome, ion – dépend du rapport entre son énergie de liaison et les énergies des processus auxquels il est soumis. Si ces énergies sont beaucoup plus petites que l'énergie de liaison, le système atomique se comporte comme une particule indivisible.
Historique
Les origines philosophiques de la notion d'atome
La notion d'atome a été formulée pour la première fois par les philosophes de la Grèce ancienne. On l'attribue à Empédocle, Démocrite, Leucippe, puis Épicure. Leurs conceptions d'une structure atomique de la matière ne procédaient pas d'observations ni d'expériences scientifiques au sens actuel, mais d'intuitions. Leur représentation de l'univers physique était fondée sur l'hypothèse que les corps sont constitués de particules très légères, invisibles et indivisibles. Cette doctrine a été diffusée au ier siècle avant J.-C. par Lucrèce, dans son De natura rerum. Il y déclare : « Les corps, ce sont d'une part les principes simples des choses, les atomes, et d'autre part les composés, formés par ces éléments premiers. Pour ceux-ci, il n'est aucune force qui puisse les détruire ; à toute atteinte leur solidité résiste... Au reste, si l'on n'admet pas dans la nature un dernier terme de petitesse, les corps les plus petits seront composés d'une infinité de parties, puisque chaque moitié aura toujours une moitié et cela à l'infini. Quelle différence y aurait-il alors entre l'univers même et le plus petit corps ? On n'en pourrait point établir ; car si infiniment étendu qu'on suppose l'univers, les corps les plus petits seraient eux aussi composés d'une infinité de parties. La droite raison se révolte contre cette conséquence et n'admet pas que l'esprit y adhère ; aussi faut-il t'avouer vaincu et reconnaître qu'il existe des particules irréductibles à toute division et qui vont jusqu'au dernier degré de la petitesse ; et, puisqu'elles existent, tu dois reconnaître aussi qu'elles sont solides et éternelles. »
Atome et chimie
Ce n'est que deux mille ans après ces énoncés qu'une théorie atomique fut scientifiquement formulée. La théorie atomique moderne est née des efforts de Dalton au début du xixe siècle pour interpréter les phénomènes quantitatifs[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- José LEITE LOPES : professeur de physique nucléaire, université Louis-Pasteur, directeur du groupe physique théorique et hautes énergies du Centre de recherche nucléaire de Strasbourg
Classification
Pour citer cet article
José LEITE LOPES. ATOME [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
DESCRIPTION DE L'ATOME
- Écrit par Bernard PIRE
- 104 mots
Ernest Rutherford (1871-1937) propose en 1911 un modèle planétaire de l'atome. L'interprétation des résultats expérimentaux obtenus par ses collaborateurs Hans Geiger et Ernest Marsden sur la déviation violente des rayons α une mince feuille d'or lui permet de comprendre qu'un atome est...
-
PARTICULES ÉLÉMENTAIRES
- Écrit par Maurice JACOB, Bernard PIRE
- 8 172 mots
- 12 médias
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES, Rémi JULLIEN
- 1 616 mots
- 7 médias
...nombreuses méthodes physiques utilisées, la spectrométrie de masse est la plus importante. Elle permet en effet de classer les agrégats selon le nombre N d'atomes ou de molécules qu'ils contiennent. Ainsi, les spectres de masses, pour certaines valeurs de N appelées « nombres magiques », font apparaître... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
La seconde voie non expérimentale est celle de la théorie physique de l'état solide.Les atomes interagissent entre eux par l'intermédiaire de leurs couches électroniques externes, lesquelles sont bien décrites par la mécanique quantique. Des modèles des alliages ont été construits pour essayer,... -
BOHR ATOME DE
- Écrit par Bernard PIRE
- 369 mots
- 1 média
Deux ans après avoir soutenu sa thèse sur la théorie électronique des métaux, le physicien danois Niels Bohr (1885-1962) écrit en 1913 trois articles fondamentaux qui révolutionnent la compréhension de la structure de la matière. Le premier, paru le 5 avril dans le Philosophical Magazine...
- Afficher les 87 références
Voir aussi
- FRÉQUENCE, physique
- ONDE ou RAYONNEMENT ÉLECTROMAGNÉTIQUE
- ABSORPTION, physique
- ISOTOPES
- POSITONIUM ou POSITRONIUM
- ORBITALES ATOMIQUES
- NOYAU ATOMIQUE
- INTERACTIONS MOLÉCULAIRES
- ÉMISSION, physique
- HAMILTONIEN
- SCHRÖDINGER ÉQUATION DE
- CRISTAL IONIQUE
- AVOGADRO LOI D'
- GAY-LUSSAC LOI DE
- SCIENCES HISTOIRE DES, XIXe s.
- MÉCANIQUE ONDULATOIRE
- MUONS
- EXCITATION, physique
- CHARGE ÉLECTRIQUE
- QUANTIQUES NOMBRES
- TRANSITION, physique
- COVALENTE LIAISON
- FONCTION D'ONDE
- COUCHES ÉLECTRONIQUES
- ÉNERGIE POTENTIELLE
- SCIENCES HISTOIRE DES, Antiquité et Moyen Âge
- BREMSSTRAHLUNG ou RAYONNEMENT DE FREINAGE
- ÉMISSION SPONTANÉE
- ÉMISSION STIMULÉE ou ÉMISSION INDUITE
- HÉLIUM
- ÉLÉMENTS CHIMIQUES
- PROPORTIONS LOI DES, chimie
- QUANTIQUE MÉCANIQUE
- PAULI PRINCIPE D'EXCLUSION DE
- POSITONS ou POSITRONS
- SOLIDES PHYSIQUE DES
- HEISENBERG RELATIONS DE ou RELATIONS D'INCERTITUDE
- COMMUTATION RELATION DE
- RÈGLES DE SÉLECTION, physique
- ÉLECTRONIQUE STRUCTURE
- FRANCK & HERTZ EXPÉRIENCE DE
- RYDBERG FORMULE DE
- PROBABILITÉ DE TRANSITION
- PÉRIODIQUE CLASSIFICATION
- NIVEAU, physique atomique
- CONFIGURATION ÉLECTRONIQUE
- MUONIUM
- ATOME ARTIFICIEL
- CHIMIE HISTOIRE DE LA
- ATOME EXOTIQUE
- HÉLIUM MUONIQUE
- SPECTRE, optique
- MOMENT CINÉTIQUE ou MOMENT ANGULAIRE
- AVOGADRO NOMBRE D'
- RYDBERG CONSTANTE DE
- RAIE SPECTRALE
- RUTHERFORD ATOME DE
- DUALITÉ ONDE-CORPUSCULE
- LENNARD-JONES POTENTIEL DE
- PHYSIQUE HISTOIRE DE LA
- SCIENCES HISTOIRE DES
- ÉTAT QUANTIQUE