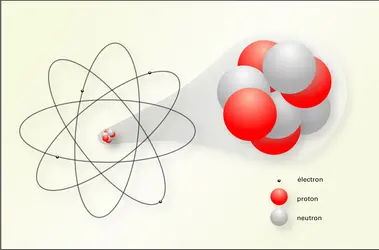
ATOME
Atome et classification périodique
Le Hamiltonien d'un atome à Z électrons peut être écrit sous une forme approximative telle que ses fonctions propres – les orbitales atomiques – soient déterminées par les quatre nombres quantiques de chaque électron A :
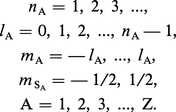
Si un tel atome se trouve à l'état fondamental, tous ses électrons doivent être dans un état dont l'énergie est la plus basse possible. La spectroscopie montre que l'état fondamental d'un grand nombre d'atomes n'est pas un état S dans lequel on aurait nA = 1, lA = 0 pour tous les électrons A = 1, 2, ..., Z. Ainsi, l'état fondamental de l'atome d'oxygène est 3P2, où la lettre P correspond à la valeur L = 2, l'indice inférieur à droite est la valeur de J, l'indice supérieur à gauche indique la multiplicité de l'état : 2 S + 1 (donc S = 1).
Comme l'état 1S (n = 1, l = 0) est l'état de plus basse énergie dans l'atome d'hydrogène, ce fait indique que dans un atome à plusieurs électrons la distribution obéit à une loi nouvelle qui doit être incorporée à la mécanique quantique. Un autre indice de l'existence d'une telle loi est la périodicité des propriétés chimiques et spectroscopiques des atomes.
C'est pour expliquer tous ces faits que Wolfgang Pauli a formulé en 1925 le principe d'exclusion. Il avait remarqué que l'état fondamental de l'ortho-hélium n'est pas l'état 3S1 correspondant aux valeurs des nombres n1 et n2 des deux électrons égales à 1. L'analyse spectrale a révélé qu'une propriété semblable était observée pour d'autres atomes, à savoir que certains états permis par la théorie n'existent pas physiquement. Pauli a ainsi découvert que tous les états dans lesquels les quatre nombres quantiques de deux électrons coïncident n'existent pas. Et il a alors donné comme un postulat fondamental pour les électrons, et toutes les particules à spin 1/2, l'énoncé suivant : deux électrons quelconques ne peuvent jamais occuper le même état quantique.
Le principe de Pauli permet d'interpréter la classification périodique des éléments.
Dans l'approximation des orbitales atomiques, on peut montrer que leurs énergies se rangent en ordre croissant pour les états suivants :
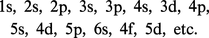
Dans l'atome d'hydrogène à l'état fondamental, les nombres quantiques de l'électron sont n = 1, l = 0, ml = 0 et ms peut avoir la valeur 1/2 ou — 1/2. Cet état est donc 2S1/2.
Des deux électrons de l'atome d'hélium, l'un occupe un état analogue à l'état fondamental d'hydrogène. L'autre électron a aussi les mêmes valeurs de n, l, m ; d'après le principe de Pauli, le nombre quantique ms du deuxième électron ne peut pas être égal à la valeur correspondante du premier électron. Les deux électrons de l'atome d'hélium auront donc leurs spins antiparallèles. L'état fondamental de cet atome sera donc 1S0, c'est-à-dire un état S (L = 0), avec J = 0, singulet. On indique souvent un tel état par la notation 1s2 : l'exposant indique le nombre d'électrons dans l'état individuel s avec la valeur de n = 1.
L'atome de lithium contient trois électrons qui se meuvent autour d'un noyau à trois charges positives. Deux de ces électrons forment une configuration analogue à celle de l'atome d'hélium. Selon le principe de Pauli, le troisième électron ne pourra pas avoir son nombre quantique principal n = 1. La valeur de n3 sera n3 = 2. Par conséquent, l3 peut être égal à 0 ou 1 : l3 = 0,1. L'expérience seule peut indiquer laquelle de ces deux valeurs est à retenir. Comme l'on a trouvé que l'état fondamental du lithium est 2S1/2, il s'ensuit que le troisième électron[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- José LEITE LOPES : professeur de physique nucléaire, université Louis-Pasteur, directeur du groupe physique théorique et hautes énergies du Centre de recherche nucléaire de Strasbourg
Classification
Pour citer cet article
José LEITE LOPES. ATOME [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
DESCRIPTION DE L'ATOME
- Écrit par Bernard PIRE
- 104 mots
Ernest Rutherford (1871-1937) propose en 1911 un modèle planétaire de l'atome. L'interprétation des résultats expérimentaux obtenus par ses collaborateurs Hans Geiger et Ernest Marsden sur la déviation violente des rayons α une mince feuille d'or lui permet de comprendre qu'un atome est...
-
PARTICULES ÉLÉMENTAIRES
- Écrit par Maurice JACOB, Bernard PIRE
- 8 172 mots
- 12 médias
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES, Rémi JULLIEN
- 1 616 mots
- 7 médias
...nombreuses méthodes physiques utilisées, la spectrométrie de masse est la plus importante. Elle permet en effet de classer les agrégats selon le nombre N d'atomes ou de molécules qu'ils contiennent. Ainsi, les spectres de masses, pour certaines valeurs de N appelées « nombres magiques », font apparaître... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
La seconde voie non expérimentale est celle de la théorie physique de l'état solide.Les atomes interagissent entre eux par l'intermédiaire de leurs couches électroniques externes, lesquelles sont bien décrites par la mécanique quantique. Des modèles des alliages ont été construits pour essayer,... -
BOHR ATOME DE
- Écrit par Bernard PIRE
- 369 mots
- 1 média
Deux ans après avoir soutenu sa thèse sur la théorie électronique des métaux, le physicien danois Niels Bohr (1885-1962) écrit en 1913 trois articles fondamentaux qui révolutionnent la compréhension de la structure de la matière. Le premier, paru le 5 avril dans le Philosophical Magazine...
- Afficher les 87 références
Voir aussi
- FRÉQUENCE, physique
- ONDE ou RAYONNEMENT ÉLECTROMAGNÉTIQUE
- ABSORPTION, physique
- ISOTOPES
- POSITONIUM ou POSITRONIUM
- ORBITALES ATOMIQUES
- NOYAU ATOMIQUE
- INTERACTIONS MOLÉCULAIRES
- ÉMISSION, physique
- HAMILTONIEN
- SCHRÖDINGER ÉQUATION DE
- CRISTAL IONIQUE
- AVOGADRO LOI D'
- GAY-LUSSAC LOI DE
- SCIENCES HISTOIRE DES, XIXe s.
- MÉCANIQUE ONDULATOIRE
- MUONS
- EXCITATION, physique
- CHARGE ÉLECTRIQUE
- QUANTIQUES NOMBRES
- TRANSITION, physique
- COVALENTE LIAISON
- FONCTION D'ONDE
- COUCHES ÉLECTRONIQUES
- ÉNERGIE POTENTIELLE
- SCIENCES HISTOIRE DES, Antiquité et Moyen Âge
- BREMSSTRAHLUNG ou RAYONNEMENT DE FREINAGE
- ÉMISSION SPONTANÉE
- ÉMISSION STIMULÉE ou ÉMISSION INDUITE
- HÉLIUM
- ÉLÉMENTS CHIMIQUES
- PROPORTIONS LOI DES, chimie
- QUANTIQUE MÉCANIQUE
- PAULI PRINCIPE D'EXCLUSION DE
- POSITONS ou POSITRONS
- SOLIDES PHYSIQUE DES
- HEISENBERG RELATIONS DE ou RELATIONS D'INCERTITUDE
- COMMUTATION RELATION DE
- RÈGLES DE SÉLECTION, physique
- ÉLECTRONIQUE STRUCTURE
- FRANCK & HERTZ EXPÉRIENCE DE
- RYDBERG FORMULE DE
- PROBABILITÉ DE TRANSITION
- PÉRIODIQUE CLASSIFICATION
- NIVEAU, physique atomique
- CONFIGURATION ÉLECTRONIQUE
- MUONIUM
- ATOME ARTIFICIEL
- CHIMIE HISTOIRE DE LA
- ATOME EXOTIQUE
- HÉLIUM MUONIQUE
- SPECTRE, optique
- MOMENT CINÉTIQUE ou MOMENT ANGULAIRE
- AVOGADRO NOMBRE D'
- RYDBERG CONSTANTE DE
- RAIE SPECTRALE
- RUTHERFORD ATOME DE
- DUALITÉ ONDE-CORPUSCULE
- LENNARD-JONES POTENTIEL DE
- PHYSIQUE HISTOIRE DE LA
- SCIENCES HISTOIRE DES
- ÉTAT QUANTIQUE