ALCOOLS
Préparations et modes de formation
Fermentation
La fermentation alcoolique des jus sucrés sous l'action de micro-organismes tels que les levures et les bactéries est une source d'alcools. L'éthanol est fabriqué industriellement par fermentation, sous l'action du complexe enzymatique zymase, présent dans la levure de bière, de mono- et disaccharides comme le glucose, le fructose, le saccharose, etc. provenant de l'hydrolyse de polysaccharides tels que l'amidon, la fécule et la cellulose ou de jus sucrés naturels comme le sucre de canne et les mélasses de sucrerie. Le butanol-1 est obtenu en mélange avec l'acétone par fermentation de sucres en C6 tels que le glucose et le fructose, en C5 (xylose), de disaccharides comme le saccharose et le lactose ou de polysaccharides (amidon), en présence d'une bactérie, le Clostridium acetobutylicum.
Synthèses industrielles
Le méthanol, qui est l'une des plus importantes matières premières industrielles de synthèse, est fabriqué par hydrogénation catalytique du monoxyde de carbone : le gaz de synthèse (CO + 2H2) obtenu soit par oxydation du méthane, soit par gazéification du charbon est traité à 250 0C et sous 50 bars par un catalyseur à base de CuO, ZnO, Al2O3 :
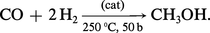
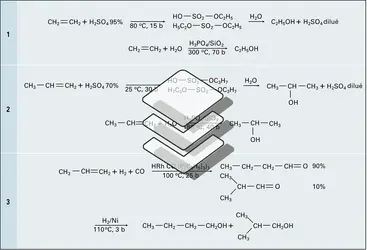
L'éthanol est fabriqué industriellement par hydratation de l'éthylène, soit indirectement par absorption par l'acide sulfurique à 95 p. 100 puis hydrolyse des esters sulfuriques d'éthyle, soit directement par passage du mélange gazeux d'éthylène et d'eau sur un catalyseur d'acide phosphorique sur silice (réactions 1).
L'hydratation indirecte du propylène par l'acide sulfurique à 75 p. 100, puis hydrolyse, ou directe sur acide phosphorique, conduit à l'isopropanol (réactions 2).
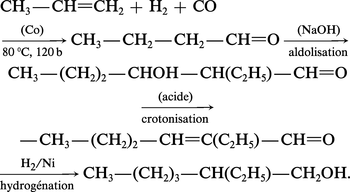
Le butane-1-ol est fabriqué par deux voies : soit l' hydroformylation du propène ou synthèse OXO sur catalyseur au cobalt ou au rhodium, suivie de l'hydrogénation du butanal, avec coproduction d'isobutanol (réaction 3) ; soit l'aldolisation de l'éthanal, la crotonisation de l'aldol puis l'hydrogénation du crotonaldéhyde :

Deux séries d'alcools supérieurs sont fabriquées : un premier groupe d'alcools primaires en C6-C9 utilisé pour la synthèse de plastifiants (esters) et un second en C12 et plus pour la fabrication de détergents. Un procédé général appelé Aldox est utilisé pour la synthèse des alcools du premier groupe : il fait intervenir l'hydroformylation d'une α-oléfine, l'aldolisation de l'aldéhyde obtenu (doublement de la chaîne carbonée), sa crotonisation et une hydrogénation :
Un second procédé permet la synthèse d'alcools primaires à chaîne linéaire à partir d'éthylène : il réalise l'oligomérisation de l'éthylène sur catalyseur de triéthylaluminium, l'oxydation du trialkylaluminium puis l'hydrolyse de l'alcoolate. Le mélange d'alcools obtenus peut contenir des chaînes de C[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. ALCOOLS [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACÉTALS
- Écrit par Jacques METZGER
- 866 mots
- 1 média
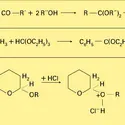
Les acétals sont les composés gem-dialcoxylés c'est-à-dire qui portent sur le même atome de carbone tétracoordiné de la chaîne deux fonction éther-oxyde. Ils dérivent formellement de l'élimination d'une molécule d'eau entre un dérivé carbonylé et deux molécules d'alcool (réaction 1). On distingue...
-
ACIDES-ALCOOLS
- Écrit par Jacques METZGER
- 1 300 mots
- 1 média
Un acide-alcool est une molécule renfermant au moins une fonction acide carboxylique et une fonction alcool.
La nature nous en fournit de nombreux exemples : acides lactique du lait aigri, malique des pommes avant maturité (diacide-monoalcool), tartrique du tartre des vins (diacide-diacool), citrique...
-
ALCÈNES ou OLÉFINES
- Écrit par Jacques METZGER
- 3 640 mots
- 4 médias
Les alcools tertiaires sont facilement déshydratés par un chauffage modéré en présence d'un catalyseur acide fort. Le mécanisme de cette élimination est normalement unimoléculaire E1 : le catalyseur acide transforme le mauvais groupe partant HO- en bon groupe partant H2O et permet ainsi... -
ALCOOL ÉTHYLIQUE ou ÉTHANOL
- Écrit par Fernand COUSSEMANT
- 694 mots
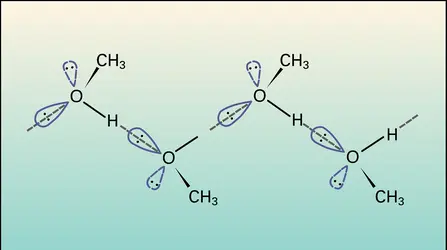
Alcool primaire, liquide incolore, d'odeur agréable, miscible à l'eau en toutes proportions, miscible à de nombreux solvants organiques, l'éthanol ou alcool éthylique, CH3—CH2OH, a les caractéristiques suivantes :
Masse moléculaire : 46,07 g
Masse spécifique : 0,789 3...
- Afficher les 20 références
Voir aussi
- HYDROLYSE
- HYDROGÈNE LIAISON
- ORGANOMAGNÉSIENS COMPOSÉS
- SOLUBILITÉ
- HYDROXYLE ou OXHYDRYLE
- HYDRATATION
- HYDROGÉNATION
- CÉTONES
- ADDITION, chimie
- DÉSHYDROGÉNATION
- ALDÉHYDES
- POLARISATION, chimie
- OXYDATION
- DÉSHYDRATATION
- CONSTANTE DIÉLECTRIQUE
- SAPONIFICATION
- ESTÉRIFICATION
- ALCOOLYSE
- MEERWEIN-PONNDORF-VERLEY RÉACTION DE
- BOUVEAULT & BLANC RÉACTION DE
- ALCOOLATES
- ÉLECTRONIQUE STRUCTURE
- NOMENCLATURE, chimie
- RÉDUCTION, chimie
- BUTANOL
- ISOPROPANOL
- ALCOOLIQUE FERMENTATION
- TEMPÉRATURE D'ÉBULLITION
- HALOGÉNURES D'ALKYLE
- HYDROFORMYLATION ou RÉACTION OXO