SULFURIQUE ACIDE
Déjà connu il y a huit cents ans sous le nom d'« esprit de vitriol », l'acide sulfurique est essentiellement un produit de l'industrie. Toutefois, sa présence est signalée dans certains torrents volcaniques de l'Amérique du Sud. Dans les sols, l'oxydation du soufre en acide est très lente à l'air humide, mais elle est favorisée par la lumière solaire et une température de 40 0C.
L'acide sulfurique (formule H2SO4) est utilisé dans de si nombreuses industries chimiques que sa préparation peut être considérée comme l'industrie de base de la chimie minérale et qu'il n'est guère possible de dénombrer tous ses emplois. Sa production dépassait déjà 10 Mt (millions de tonnes) au début du xxe siècle, atteignait 38 Mt en 1955 et 160 en 1990. En 2005, la France en a produit 1,5 Mt.
La fabrication des engrais, superphosphates et sulfate d'ammonium, est le premier consommateur, avec une demande voisine du tiers de la production. Ce principal emploi n'est pas près de connaître un ralentissement compte tenu des immenses besoins à satisfaire dans ce domaine. L'industrie chimique l'utilise en chimie minérale, synthèse organique, produits fluorés. On peut également citer l'industrie des pigments minéraux ; l'industrie du pétrole l'utilise pour le raffinage. Enfin, parmi les activités les plus diverses utilisant l'acide sulfurique, citons les industries textiles et alimentaires, le décapage métallurgique, la préparation des détergents et celle des explosifs.
Propriétés
L'acide sulfurique anhydre, liquide incolore, inodore et visqueux, de poids spécifique 1,83 à + 15 0C, se solidifie à + 10,35 0C et forme plusieurs hydrates de formule générale H2SO4, nH2O (n = 1, 2, 3, 4, 6). La température de solidification varie de façon importante avec le degré d'hydratation.
L'addition d'eau à l'acide sulfurique produit un dégagement de chaleur considérable, en même temps qu'une contraction du volume total. Mis en contact avec la peau, l'acide pur occasionne de sérieuses brûlures. En conséquence, il faut avoir soin de verser lentement l'acide dans l'eau ; l'opération inverse provoque une réaction extrêmement violente avec projection d'acide.
La concentration de l'acide obtenu par dilution est indiquée en pourcentage de H2SO4 ou en degrés Baumé. Le degré Baumé français est défini par la formule :
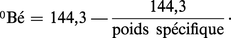
Certains pays utilisent une constante légèrement différente. L'acide concentré correspond aux acides de 65 à 66 degrés Baumé, avec 92 à 96 p. 100 de H2SO4.
L'acide sulfurique est un agent déshydratant efficace ; très avide d'eau, il fixe l'humidité de l'air.
Le point d'ébullition de l'acide dilué évolue avec la concentration. La distillation tend à amener le liquide à la composition de 98,3 p. 100 de H2SO4 pour laquelle la température d'ébullition est la plus élevée (330 0C environ sous 750 mm de Hg). L'acide gazeux est alors partiellement dissocié en SO3 et H2O.
L'acide sulfurique absolu (100 p. 100) dissout SO3. Les solutions obtenues sont appelées oléums ou acides fumants (en raison de la tension de vapeur de SO3). Ces produits sont vendus avec l'indication du pourcentage en SO3 dissous dans H2SO4 anhydre. Introduit en légère proportion, l'anhydride donne naissance à l'acide pyrosulfurique ou disulfurique H2S2O7 :
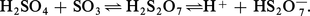
Les oléums plus concentrés contiennent des acides polysulfuriques H2O(SO3)n dont seuls les termes H2S3O10 et H2S4O13 sont bien connus.
La conductivité présentée par l'acide absolu résulte d'une auto-ionisation de la molécule H2SO4 :
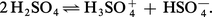
Dans les solutions aqueuses diluées, la première ionisation de l'acide est complète :
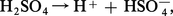

La tendance de l'acide[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Gabriel TRIDOT : professeur à l'université des sciences et techniques de Lille-I
Classification
Pour citer cet article
Gabriel TRIDOT. SULFURIQUE ACIDE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 25/03/2009
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
Les associations entre molécules de solvant sont ici très fortes, comme en témoignent les viscosité et température d'ébullition élevées. -
BÉRYLLIUM
- Écrit par Jean-Paul CARRON , Robert GADEAU et Jean PERROTEY
- 5 410 mots
- 6 médias
L'attaqueau moyen de l'acide sulfuriquecomprend plusieurs étapes : le béryl n'étant pas directement soluble, on peut le rendre réactif par fusion, vers 1 650 0C, au four électrique ; le minerai fondu est grenaillé dans l'eau, puis on le cuit à 900 0C pour précipiter la... -
CADMIUM
- Écrit par Alexandre TRICOT
- 8 050 mots
- 6 médias
L' anhydride sulfureux SO2 produit est consommé en totalité pour la fabrication de l'acide sulfurique H2SO4. -
CATALYSE
- Écrit par Henri Jean-Marie DOU et Jean-Eugène GERMAIN
- 8 394 mots
- 7 médias
L'une des plus anciennes fabrications de l'industrie chimique, celle de l'acide sulfurique par le procédé des chambres de plomb, illustre la catalyse d'oxydation du gaz sulfureux par l'air en présence d'oxyde azotique (Clément et Desormes, 1806), schématisée de la même façon :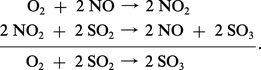
- Afficher les 14 références







