HÉMOGLOBINE
Structure et fonction de la molécule
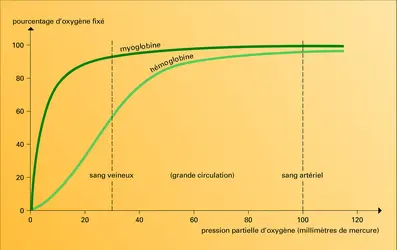
Félix Haurowitz a découvert en 1938 que la désoxyhémoglobine et l' oxyhémoglobine cristallisaient différemment, comme si elles étaient chimiquement différentes, ce qui implique que l'hémoglobine n'est pas un bidon d' oxygène mais un poumon moléculaire dont la structure change selon qu'il capte l'oxygène ou qu'il s'en décharge.
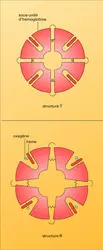
En 1965, Jacques Monod et J.-P. Changeux, ainsi que Jeffries Wyman ont expliqué cette particularité par la notion d' allostérie. Selon celle-ci, les deux structures se distinguent par l'arrangement des sous-unités et par le nombre et la force de leurs liaisons mutuelles. L'une peut développer pleinement son affinité avec l'oxygène à cause de la faiblesse et de la rareté de ces liaisons. C'est la structure R, ou « relaxée ». L'autre, à basse affinité, du fait des liaisons plus nombreuses et plus fortes entre les sous-unités, est dite structure T, ce qui signifie « tensive ». Dans chacune de ces structures l'affinité pour l'oxygène des diverses sous-unités d'une même molécule devrait rester invariable.
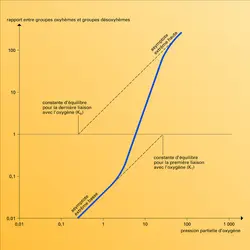
Ce postulat a conduit à décrire les propriétés des molécules allostériques en utilisant un modèle mathématique à trois variables indépendantes : KR et KT, qui caractérisent comme on l'a vu plus haut les constantes d'équilibre de la liaison de l'oxygène avec l'hémoglobine (selon la structure R ou T de celle-ci) et L qui exprime le rapport, mesuré en l'absence d'oxygène, du nombre des molécules à structure T au nombre des molécules R (fig. 3).
Cette ingénieuse théorie simplifie grandement l'interprétation de l'effet coopératif. L'affinité croissante pour l'oxygène, que nous avons illustrée par la parabole du riche et du pauvre, ne provient pas de quelque interaction directe entre les hèmes mais de la translation d'une structure T à basse affinité à une structure R à haute affinité. Cette modification pourrait se produire soit quand la seconde molécule d'oxygène se lie, soit quand la troisième vient se fixer. Des agents chimiques qui ne se fixent pas aux hèmes peuvent donc abaisser l'affinité pour l'oxygène en biaisant l'équilibre entre les deux structures en faveur de la forme T, tout en ménageant la transition ultérieure à la forme R, d'où trois molécules d'oxygène liées, alors que deux seulement l'avaient été initialement. En termes d'allostérie, de tels agents élèveraient L, nombre relatif des molécules à structure T, sans altérer les constantes d'équilibre KT et KR des deux structures. En fait, tous ces agents augmentent KT en même temps.
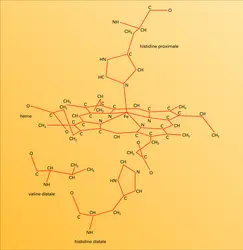
La structure globale des sous-unités est semblable dans la myoglobine et dans les chaînes α et β de l'hémoglobine (fig. 4). Les chaînes α renferment 7 segments hélicoïdaux et les chaînes β en contiennent 8, raccordés par des coudes et des segments non hélicoïdaux. Chaque chaîne enveloppe son hème dans une profonde poche qui expose seulement le côté d'où les chaînes d'acide propionique de la porphyrine peuvent plonger dans l'eau environnante. L'hème est en contact avec des chaînons latéraux de 16 aminoacides à partir des 7 segments de chaîne α ou β.
La plupart de ces chaînons sont hydrocarbonés, avec deux exceptions, celles des histidines liées à l'hème, de part et d'autre de celui-ci, jouant un rôle important dans la liaison avec l'oxygène. La partie terminale du chaînon de l'histidine en cause est un cycle imidazole à 3 atomes de carbone, deux atomes d'azote et 4 ou 5 d'hydrogène. L'une des histidines, dite proximale, est liée à l'atome de fer de l'hème (fig. 5). L'autre histidine, dite distale, s'attache du côté opposé de l'hème par une liaison hydrogène avec l'oxygène fixé. À part ces chaînons histidine,[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Max Ferdinand PERUTZ : Dr., membre du M.R.C. Laboratory of Molecular Biology
Classification
Pour citer cet article
Max Ferdinand PERUTZ. HÉMOGLOBINE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIDO-BASIQUE ÉQUILIBRE
- Écrit par Pierre KAMOUN
- 2 955 mots
- 1 média
Le système érythrocytaire est constitué par l'ensemble hémoglobine- oxyhémoglobine qui, pour le pH sanguin normal, jouent le rôle d'acides faibles. Cependant, la constante de dissociation de l'oxyhémoglobine est supérieure à celle de l'hémoglobine, ce qui revient à dire que... -
ANÉMIES
- Écrit par Bruno VARET
- 3 091 mots
- 5 médias
Lesvaleurs suivantes sont généralement considérées pour définir une anémie : hémoglobine inférieure à 13 grammes chez l'homme après la puberté ; à 12 grammes chez la femme et chez l'enfant avant la puberté ; à 10,5 grammes chez la femme enceinte de plus de trois mois ; à 14 grammes chez le nouveau-né.... -
BRAGG sir WILLIAM HENRY (1862-1942) & sir WILLIAM LAWRENCE (1890-1971)
- Écrit par Christian BRACCO
- 1 790 mots
- 1 média
...la physique nucléaire développée par son prédécesseur. William Lawrence Bragg encourage dès 1938 le travail de Max Ferdinand Perutz (1914-2002) sur la structure de l’hémoglobine, d’une complexité sans commune mesure avec ce qui avait été tenté jusqu’alors. M. Perutz et John Cowdery Kendrew... -
FER - Rôle biologique du fer
- Écrit par Carole BEAUMONT
- 4 731 mots
- 3 médias
Les besoins en fer sont très importants au cours de l'érythropoïèse, principalement pour assurer la synthèse d'hème et la formation del'hémoglobine. Les précurseurs érythropoïétiques de la moelle osseuse, qui ne peuvent acquérir leur fer que par le biais de la transferrine, expriment à leur... - Afficher les 26 références
Voir aussi
- FŒTALE VIE
- HYDROGÈNE LIAISON
- GLOBINE
- ALLOSTÉRIE
- STRUCTURE, biologie
- MYOGLOBINE
- POLYPEPTIDIQUE CHAÎNE
- HISTIDINE
- HÈME
- HÉMOPROTÉINES
- OXYHÉMOGLOBINE
- BICARBONATE
- BOHR EFFET, physiologie
- HÉMATIE ou GLOBULE ROUGE ou ÉRYTHROCYTE
- HILL COEFFICIENT DE
- RESPIRATION
- GAZ DU SANG
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- MOLÉCULES BIOLOGIQUES, structure et fonction
- ÉCHANGES GAZEUX, physiologie
- PRESSION PARTIELLE
- PROTÉINES
- CARBONIQUE GAZ ou DIOXYDE DE CARBONE