HÉMOGLOBINE
Effets coopératifs dans la fixation d'oxygène
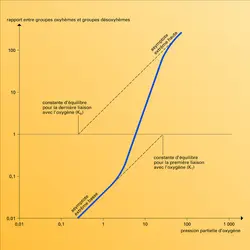
On désigne sous ce nom l'interaction hème-hème et aussi d'autres mécanismes modifiant réversiblement l' affinité de l'hémoglobine pour l'oxygène. Cette affinité, et le coefficient de Hill qui l'exprime, dépendent de la concentration de divers facteurs dans le globule rouge : protons (atomes d'hydrogène dépourvus d'électrons dont la concentration peut être évaluée par le pH), dioxyde de carbone (CO2), ions chlore (Cl–) et un composé associant acide glycérique et phosphate que l'on appelle le 2.3. diphosphoglycérate (DPG).
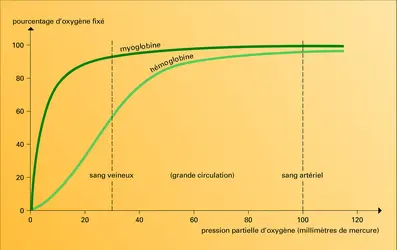
Accroître la concentration de chacun d'eux déplace la courbe d'équilibre de l'oxygénation vers la droite, dans le sens de l'affinité plus faible pour l'oxygène, et accentue la forme sigmoïde de la courbe. Curieusement, aucun de ces facteurs n'influence (comme le fait la température) la courbe d'équilibre de l'oxygénation de la myoglobine, bien que, pourtant, sa molécule soit chimiquement et structurellement très comparable à une sous-unité de l'hémoglobine.
Quelle est la signification de ces effets extraordinaires ? Pourquoi ne suffit-il pas au globule rouge d'être un simple transporteur d'oxygène comme la myoglobine ? Parce qu'un tel transporteur ne permettrait pas le départ d'une assez grande quantité d'oxygène du globule rouge vers les tissus, et il ne permettrait pas au plasma sanguin de contenir assez de gaz carbonique destiné à l'excrétion pulmonaire. La pression partielle d'oxygène dans les poumons est d'environ 100 mm de mercure, ce qui suffit pour saturer d'oxygène l'hémoglobine, que la courbe d'équilibre soit sigmoïde ou hyperbolique. Dans le sang veineux, la pression partielle n'est plus que de 35 mm et, si la courbe était hyperbolique (comme celle de la myoglobine) il ne serait libéré, sous une telle pression, qu'à peine 10 p. 100 de l'oxygène transporté, ce qui entraînerait l'asphyxie du sujet respirant pourtant normalement, mais il en sera libéré en fait cinq fois plus !
Plus la forme de la courbe d'équilibre est sigmoïde, plus la fraction d'oxygène libérée est importante. Divers facteurs y contribuent. L'oxydation des nutriments par les tissus libère des acides, lactique et carbonique ; ces acides fournissent des protons qui déplacent la courbe vers la droite, vers la moindre affinité de l'oxygène pour l'hémoglobine, accentuant sa forme sigmoïde. Le DPG joue aussi un rôle important. Le nombre des molécules de DPG dans le globule rouge est à peu près égal à celui des molécules d'hémoglobine, 280 millions, et il reste à peu près constant, probablement, pendant la circulation ; une insuffisance d'oxygène dans le sang entraîne une fabrication accrue de DPG, laquelle contribue à libérer davantage d'oxygène. Ainsi, dans le cas de la courbe sigmoïde typique, près de 50 p. 100 de l'oxygène transporté est cédé aux tissus. En revanche, chez le fœtus humain, l'hémoglobine renferme bien les mêmes chaînes α que celles de l'adulte mais les chaînes β sont différentes, déterminant une moins grande affinité pour le DPG. Il s'ensuit que l'hémoglobine fœtale possède une plus grande affinité pour l'oxygène, ce qui facilite le transfert de ce gaz du sang maternel au sang du fœtus.
Le monoxyde de carbone (CO) peut se lier avec le fer de l' hème, au même site que l'oxygène, mais avec une affinité 250 fois plus grande ; il en chasse donc l'oxygène, ce qui explique sa grande toxicité. Chez les grands fumeurs, plus de 15 p. 100 des sites de combinaison de l'oxygène peuvent être ainsi bloqués par CO, d'où la diminution de la quantité d'oxygène transportée par le sang. Mais le monoxyde de carbone a un effet plus pernicieux encore.[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Max Ferdinand PERUTZ : Dr., membre du M.R.C. Laboratory of Molecular Biology
Classification
Pour citer cet article
Max Ferdinand PERUTZ. HÉMOGLOBINE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIDO-BASIQUE ÉQUILIBRE
- Écrit par Pierre KAMOUN
- 2 955 mots
- 1 média
Le système érythrocytaire est constitué par l'ensemble hémoglobine- oxyhémoglobine qui, pour le pH sanguin normal, jouent le rôle d'acides faibles. Cependant, la constante de dissociation de l'oxyhémoglobine est supérieure à celle de l'hémoglobine, ce qui revient à dire que... -
ANÉMIES
- Écrit par Bruno VARET
- 3 091 mots
- 5 médias
Lesvaleurs suivantes sont généralement considérées pour définir une anémie : hémoglobine inférieure à 13 grammes chez l'homme après la puberté ; à 12 grammes chez la femme et chez l'enfant avant la puberté ; à 10,5 grammes chez la femme enceinte de plus de trois mois ; à 14 grammes chez le nouveau-né.... -
BRAGG sir WILLIAM HENRY (1862-1942) & sir WILLIAM LAWRENCE (1890-1971)
- Écrit par Christian BRACCO
- 1 790 mots
- 1 média
...la physique nucléaire développée par son prédécesseur. William Lawrence Bragg encourage dès 1938 le travail de Max Ferdinand Perutz (1914-2002) sur la structure de l’hémoglobine, d’une complexité sans commune mesure avec ce qui avait été tenté jusqu’alors. M. Perutz et John Cowdery Kendrew... -
FER - Rôle biologique du fer
- Écrit par Carole BEAUMONT
- 4 731 mots
- 3 médias
Les besoins en fer sont très importants au cours de l'érythropoïèse, principalement pour assurer la synthèse d'hème et la formation del'hémoglobine. Les précurseurs érythropoïétiques de la moelle osseuse, qui ne peuvent acquérir leur fer que par le biais de la transferrine, expriment à leur... - Afficher les 26 références
Voir aussi
- FŒTALE VIE
- HYDROGÈNE LIAISON
- GLOBINE
- ALLOSTÉRIE
- STRUCTURE, biologie
- MYOGLOBINE
- POLYPEPTIDIQUE CHAÎNE
- HISTIDINE
- HÈME
- HÉMOPROTÉINES
- OXYHÉMOGLOBINE
- BICARBONATE
- BOHR EFFET, physiologie
- HÉMATIE ou GLOBULE ROUGE ou ÉRYTHROCYTE
- HILL COEFFICIENT DE
- RESPIRATION
- GAZ DU SANG
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- MOLÉCULES BIOLOGIQUES, structure et fonction
- ÉCHANGES GAZEUX, physiologie
- PRESSION PARTIELLE
- PROTÉINES
- CARBONIQUE GAZ ou DIOXYDE DE CARBONE