HÈME
Articles
-
ANÉMIES
- Écrit par Bruno VARET
- 3 091 mots
- 5 médias
– d'une anomalie de la synthèse du noyau tétra-pyrrolique de l'hème : généralement constitutionnelles (porphyries), ces anomalies ne retentissent que rarement sur l'érythropoïèse ; seule la porphyrie érythropoïétique s'accompagne d'une anémie qui est de mécanisme hémolytique. -
CHLOROPHYLLES
- Écrit par Alexis MOYSE
- 3 547 mots
- 4 médias
Il faut également souligner la parenté chimique entre la chlorophylle, l'hémochromogène (ou hème de l'hémoglobine) et l'hématine qui en dérive. Il s'agit toujours de molécules à quatre noyaux pyrroliques. Mais dans l'hème, ces noyaux sont liés à un atome de fer et il n'y... -
FER - Rôle biologique du fer
- Écrit par Carole BEAUMONT
- 4 731 mots
- 3 médias
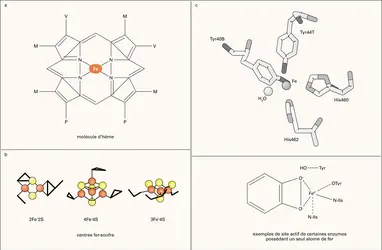
Chez les hémoprotéines, le fer est présent sous forme d'hème, lié aux quatre noyaux pyrroles d'une molécule de porphyrine IX (fig. 1a). L'hème est le groupement prosthétique de protéines de transport d'oxygène (hémoglobine, myoglobine), d'activateurs de l'oxygène moléculaire (cytochrome P450, cytochromes... -
FISCHER HANS (1881-1945)
- Écrit par Georges BRAM
- 357 mots
Chimiste allemand né à Höchst am Main et décédé à Munich. Fischer mène de front des études médicales et des études de chimie. Il obtient le doctorat en chimie en 1904 à l'université de Marbourg et le doctorat en médecine en 1908 à l'université de Munich. Il passe un an à Berlin en tant qu'assistant...
-
HÉMOGLOBINE
- Écrit par Max Ferdinand PERUTZ
- 3 883 mots
- 7 médias
Le monoxyde de carbone (CO) peut se lier avec le fer de l'hème, au même site que l'oxygène, mais avec une affinité 250 fois plus grande ; il en chasse donc l'oxygène, ce qui explique sa grande toxicité. Chez les grands fumeurs, plus de 15 p. 100 des sites de combinaison de l'oxygène peuvent être ainsi... -
HÉMOGLOBINOPATHIES
- Écrit par Michel COHEN-SOLAL, Jean-Claude DREYFUS
- 3 852 mots
- 6 médias
Le fer de l'hème existe normalement à l'état ferreux divalent. Il est relié à la globine par des liaisons faibles. Certaines mutations modifient les relations entre l'hème et la globine. Le fer est alors oxydé en fer ferrique trivalent. L'hémoglobine est transformée en méthémoglobine qui n'est pas capable... -
PORPHYRINES
- Écrit par Alfred GAJDOS
- 3 194 mots
- 3 médias
...(porphyrine biologiquement la plus importante chez les Mammifères, donc chez l'homme) n'existe dans la nature que sous une seule forme isomérique, correspondant à l'isomère III des autres porphyrines. Combinée à un atome de fer, elle constitue l'hème des hémoprotéines (hémoglobine, myoglobine, etc.).
Médias