LITHIUM
Le lithium est un métal blanc et brillant lorsqu'il est fraîchement coupé. Il a été découvert, en 1817, par Johann August Arfvedson dans un silicate d'aluminium naturel : le pétalite. Jöns Jacob Berzelius donna au nouvel élément, de numéro atomique Z = 3, le nom de lithion (du grec λ́ιθος, pierre) pour rappeler son origine minérale. C'est le plus léger de tous les éléments métalliques : sa densité est de 0,534 ; il fond à 180 0C et bout à 1 330 0C.
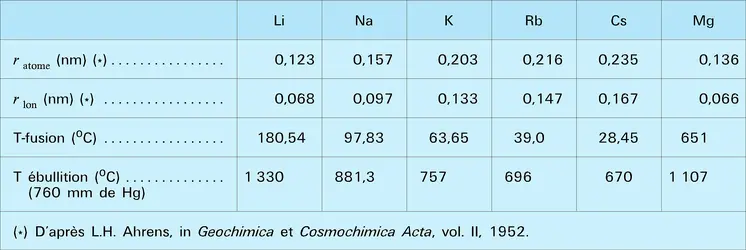
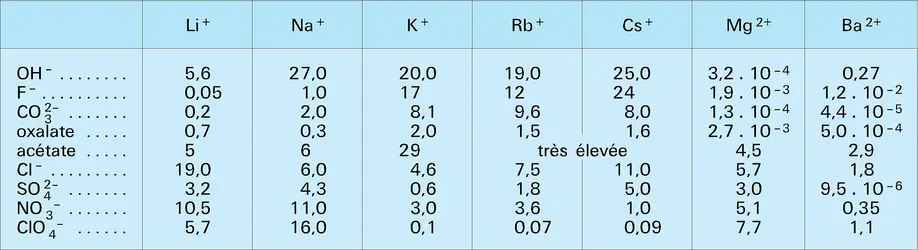
Comme l'indique sa structure électronique fondamentale 1 s2 2 s1, il appartient au sous-groupe IA de la classification périodique des éléments ; il est le premier terme de la famille des métaux alcalins. Les propriétés fondamentales de ces éléments sont liées à la présence d'un seul électron périphérique ns1 surmontant une couche très stable de type 2 (Li) ou 2-6 (Na, K, Rb, Cs) : ce sont tous des éléments monovalents, dotés d'un rayon atomique important, très électropositifs, extrêmement réactifs et qui donnent essentiellement des liaisons ioniques. Le lithium, tout en possédant les propriétés caractéristiques de la famille à laquelle il appartient, se singularise par la position particulière qu'il y occupe et présente, en vertu de la règle des analogies diagonales dans le tableau périodique, de nombreux points communs avec le magnésium et les alcalino-terreux. Ce comportement particulier du lithium est dû au fait que Li+ est, parmi les cations alcalins, celui qui possède le rayon le plus petit, donc le rapport charge-taille le plus élevé, ce qui lui confère un pouvoir polarisant important. Le pouvoir polarisant du cation Li+ est, entre autres, responsable de l'apparition d'un caractère covalent dans les combinaisons organiques et minérales du lithium – alors que celles des alcalins supérieurs sont typiquement ioniques –, de la formation d'hydrates et de complexes en solution, et des très grandes différences de solubilité des sels de lithium par rapport à ceux de potassium, de rubidium et de césium.
Le lithium s'apparente aussi à certains métaux de transition par la faible valeur de son rayon ionique ; il peut ainsi se substituer à ces métaux dans des oxydes mixtes tels que les spinelles, par exemple.
État naturel et extraction
Le lithium n'entre que pour 0,003 à 0,005 p. 100 dans la composition de l'écorce terrestre, et les minéraux titrant plus de 2 p. 100 en oxyde Li2O sont rares : l'extraction du lithium est une opération longue et coûteuse. Les principaux minerais sont des silicates comme le feldspathoïde pétalite
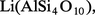
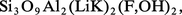
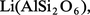
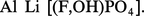
Les principaux gisements de spodumène se trouvent en ex-U.R.S.S., au Zimbabwe et en Chine. Les autres pays producteurs de lithium sont l'Australie, le Chili, le Brésil et différents États africains. Les minerais sont attaqués à chaud par l'acide sulfurique concentré. Le triphane, qui est le minerai le plus abondant, doit être calciné au préalable à 1 100 0C pour être facilement attaqué, la forme naturelle dite α se transforme en une phase dite β de structure différente moins dense (d = 2,4 au lieu de 3,2) ; dans ces conditions, les ions H+ de l'acide se substituent aux ions Li+ du minerai qui passent ainsi en solution sans qu'il soit nécessaire de solubiliser l'aluminium. Le lithium est séparé sous forme de carbonate Li2CO3. La purification des sels de lithium se fait soit par précipitation répétée d'une combinaison soluble (carbonate, phosphate, fluorure), soit par dissolution sélective du chlorure dans l'éthanol.
La préparation du métal se fait exclusivement par électrolyse du chlorure de lithium fondu, additionné de chlorure de potassium. Le métal brut qui se dépose sur la cathode de fer est purifié des autres alcalins qu'il[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Roger NASLAIN : docteur ès sciences, ingénieur chimiste, professeur à l'université de Bordeaux-I
- Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Pour citer cet article
Universalis et Roger NASLAIN. LITHIUM [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ATOME
- Écrit par José LEITE LOPES
- 9 140 mots
- 13 médias
L'atome de lithium contient trois électrons qui se meuvent autour d'un noyau à trois charges positives. Deux de ces électrons forment une configuration analogue à celle de l'atome d'hélium. Selon le principe de Pauli, le troisième électron ne pourra pas avoir son nombre quantique principal ... -
GOODENOUGH JOHN B. (1922-2023)
- Écrit par Bernard PIRE
- 1 163 mots
- 1 média
...d’Oxford (Royaume-Uni) pour diriger un laboratoire de chimie inorganique. Le chimiste Stanley Whittingham (né en 1941) développe alors les premières batteries au lithium ionique rechargeables pour le compte du centre de recherche de la compagnie Exxon, à Linden (New Jersey, États-Unis). Celles-ci sont... -
MÉTAUX - Métaux alcalins
- Écrit par Jean PERROTEY
- 3 023 mots
- 4 médias
-
MÉTAUX RARES
- Écrit par Christian HOCQUARD
- 6 441 mots
- 7 médias
La demande en carbonate de lithium va croître rapidement avec la commercialisation massive d'automobiles électriques à batteries lithium-ion (Li-ion). Différentes utilisations sont également attendues dans d'autres secteurs : nouveaux alliages aluminium-lithium destinés à l'industrie aérospatiale ; la... - Afficher les 12 références
Voir aussi