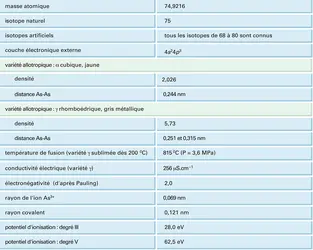
ARSENIC
Chimie analytique
La recherche qualitative de l'arsenic et son dosage revêtent un aspect particulier du fait de leur importance en toxicologie et en pharmacologie, où des résultats fidèles et précis sont exigés. Au laboratoire, l'arsenic peut être isolé à l'état de sulfure arsénieux jaune, précipité en milieu acide par un courant d'hydrogène sulfuré. Le dosage des solutions arsénieuses se fait à l'aide d'une solution d'iode, titrée en présence d'un excès de bicarbonate de sodium qui élimine l'acide iodhydrique au moment même de sa formation, ce qui déplace l'équilibre et rend la réaction quantitative :
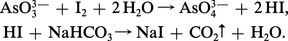
Plusieurs méthodes ont été proposées pour caractériser l'arsenic sans risque d'erreur, la confusion avec l'antimoine étant la plus fréquente. Le test de Reinsch consiste à plonger une lame de cuivre dans une solution chlorhydrique à étudier ; l'arsenic s'y dépose sous forme d'arséniure Cu5As2. Le composé le plus facile à utiliser est l'hydrogène arsénié préparé par attaque de l'échantillon à analyser par du zinc et de l'acide sulfurique spécialement purifiés pour en éliminer l'arsenic ; dans ces conditions, l'attaque se fait mal et doit être provoquée en ajoutant une goutte de solution de sulfate de cuivre également exempt d'arsenic. L'arsine est entraînée par le courant d'hydrogène qui se dégage ; un tampon de laine de verre, placé sur le circuit gazeux, intercepte les particules solides et les gouttelettes liquides qui auraient pu être entraînées. Cette méthode, dite de Marsh, est universellement utilisée en toxicologie. Le courant d'hydrogène, éventuellement porteur de produits arséniés, traverse un tube de silice fortement chauffé en un point ; l'arsine s'y décompose et l'arsenic se condense dans la partie froide du tube où un miroir se forme. L'antimoine réagit de la même manière, mais n'est pas soluble à froid dans une solution d'hypochlorite de sodium, ce qui permet la distinction avec l'arsenic. On peut comparer l'anneau d'arsenic formé avec une série d'anneaux étalons obtenus avec des échantillons contenant des quantités connues d'arsenic.
Des méthodes de dosages conductimétriques de haute précision, à l'aide d'une solution très diluée d'iode, font espérer une précision de 1 p. 100 dans le cas d'une masse d'arsenic qui peut être inférieure à 1 microgramme. Frédéric Joliot-Curie, nommé expert dans une affaire d'empoisonnement criminel, a mis au point une méthode d'irradiation des échantillons qui provoque la formation d'isotopes radioactifs de l'arsenic ; en suivant à l'aide d'un compteur Geiger la désintégration de ces isotopes, la recherche des traces d'arsenic peut atteindre une précision bien supérieure.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean PERROTEY : docteur ès sciences, maître assistant à l'université de Haute-Normandie
Classification
Pour citer cet article
Jean PERROTEY. ARSENIC [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ARSENIC, toxicologie
- Écrit par Universalis
- 255 mots
L'arsenic entrait autrefois dans la composition de nombreux produits insecticides, raticides, pesticides comme de certaines peintures, papiers peints et céramiques.
L'empoisonnement arsenical chez l'homme résulte souvent de l'ingestion ou de l'inhalation d'un insecticide contenant oxyde arsénieux,...
-
ANTIMOINE
- Écrit par Universalis, Jean PERROTEY
- 3 875 mots
- 3 médias
...essentiellement par des dérivés organiques, tandis que les composés + III sont les plus nombreux et que la stabilité du degré + V est plus faible que chez l'arsenic. Par l'ensemble de ses propriétés, l'antimoine est très proche de l'arsenic, avec un caractère métallique plus accentué. Le potentiel électrochimique de... -
LÖLLINGITE
- Écrit par Yannick LOZAC'H
- 306 mots
-
MATIÈRE (physique) - État solide
- Écrit par Daniel CALÉCKI
- 8 629 mots
- 12 médias
L'atome d'arsenic possède cinq électrons de valence et trois places vacantes sur sa couche externe. Dans un cristal d'arsenic, chaque atome établit trois liaisons covalentes avec trois atomes premiers voisins. Ces liaisons forment un trièdre, l'angle entre deux liaisons étant égal à 92,8... -
OLIGOÉLÉMENTS
- Écrit par Jean LAVOLLAY
- 3 576 mots
- 1 média
- Afficher les 9 références
Voir aussi