AMMONIAC
Propriétés physiques
L' ammoniac est un gaz incolore, d'odeur vive, à saveur caustique, irritant les muqueuses. Ses caractéristiques physiques essentielles sont indiquées dans le tableau. Elles sont comme celles de l'eau, anormales si on les compare à celles des autres hydrures volatils (phosphine, arsine, stibine). Les températures de fusion et d'ébullition sont plus élevées ; sa chaleur d'évaporation anormalement élevée permet, compte tenu de sa basse température d'ébullition, d'utiliser l'ammoniac comme frigorigène.
Ces anomalies s'expliquent par l'existence de liaisons hydrogène entre les atomes d'hydrogène d'une molécule et les atomes d'azote de molécules différentes.
On a élaboré une chimie acidobasique de l'ammoniac liquide calquée sur celle de l'eau.
Grâce à sa constante diélectrique très élevée, l'ammoniac liquide constitue, en effet, comme l'eau, un solvant ionisant pour les électrolytes, compte tenu de sa très faible conductibilité électrique, due à une auto-ionisation peu importante :
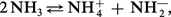
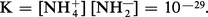
Tous les sels d'ammonium se dissolvent facilement dans l'ammoniac liquide ainsi que la plupart des sels métalliques correspondant à un anion monovalent (nitrates, nitrites, cyanures, halogénures, etc.) ; au contraire, lorsque l'anion porte plusieurs charges, le sel est généralement insoluble (sulfates, carbonates, phosphates, oxalates, sulfures...). Les oxydes et hydroxydes métalliques sont insolubles.
La comparaison avec l'auto-ionisation de l'eau pure est immédiate et on considérera respectivement, comme acides et comme bases, des produits qui, au sein de l'ammoniac, libéreront respectivement NH4+ et NH2— au lieu de H+ et OH—.
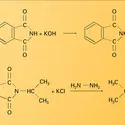
Dans l'ammoniac liquide, les sels d'ammonium possèdent donc une fonction acide ; il en est de même de tous les composés se comportant comme des acides en milieu aqueux, car la libération de protons est équivalente à la libération d'ions ammonium par réaction sur le solvant :
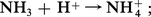
La neutralisation d'un acide par une base provoque aussi la formation d'un sel, avec libération d'une ou de plusieurs molécules de solvant :
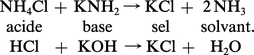
L'équivalence des deux systèmes acide-base est totale. Dans le cas de l'eau, on passe d'un hydroxyde à un oxyde par perte d'une molécule d'eau ; dans le cas de l'ammoniac, on passe d'un amidure à un nitrure par perte d'ammoniac :
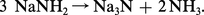
Comme les hydroxydes de zinc et d'aluminium, les amidures correspondants, ainsi que ceux des métaux alcalins et alcalino-terreux, ceux du plomb, de l'étain, du magnésium présentent un caractère amphotère et la base précipitée au cours d'une réaction se redissout dans un excès de réactif :

L'action des sels d'ammonium sur les métaux dans l'ammoniac liquide est semblable à celle des acides en phase aqueuse : on obtient un sel du métal attaqué et un dégagement d' hydrogène :
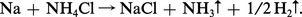
Les métaux dont l'hydroxyde a un caractère amphotère sont attaqués par les bases, également avec dégagement d'hydrogène :
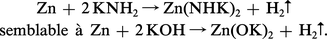
Des réactions plus complexes, comme l' hydrolyse, avec précipitation de sels basiques, trouvent aussi leur équivalent dans l'ammoniac liquide par réaction d'ammoniolyse :

Cela montre bien, comme le pensait le chimiste américain E. C. Franklin dès 1912, que l'eau ne constitue qu'un solvant parmi les autres, et que tout liquide auto-ionisé devait permettre de définir une chimie acido-basique particulière. Ajoutons que l'ammoniac liquide dissout aisément les métaux alcalins et alcalino-terreux et que les solutions ainsi obtenues présentent des propriétés caractéristiques.
Soulignons enfin que l'ammoniac liquide possède une[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri GUÉRIN : ingénieur de l'École supérieure de physique et chimie industrielles, professeur honoraire de l'université de Paris-XI
Classification
Pour citer cet article
Henri GUÉRIN. AMMONIAC [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER, Pierre SOUCHAY
- 12 364 mots
- 7 médias
La structure de l'ammoniac liquide, qui bout à — 33 0C, rappelle beaucoup celle de l'eau, en raison de l'existence de liaisons hydrogène. Il s'ionise suivant :Ke = [NH4+][NH2—]est de l'ordre de 3 × 10—33. La limite inférieure de l'échelle d'acidité est par...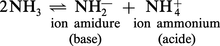
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 350 mots
- 4 médias
L'ammoniac s'additionne sur les aldéhydes, en formant un hémiaminal instable, qui se déshydrate en donnant une aldimine, généralement trimère. Le méthanal réagit d'une manière particulière avec l'ammoniac : la formaldimine, initialement formée, se condense avec deux molécules de méthanal en un composé... -
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
L' alkylation de l'ammoniac par les halogénures d'alkyle en solution aqueuse ou alcoolique est la méthode proposée en 1850 par A. W. von Hofmann pour leur préparation. Cette réaction conduit à un mélange de dérivés primaires, secondaires et tertiaires, ainsi qu'à l'halogénure d'ammonium quaternaire.... -
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 165 mots
- 6 médias
- Afficher les 23 références
Voir aussi
- SELS
- NITRATATION
- NEUTRALISATION, chimie
- HYDROLYSE
- HYDROGÈNE LIAISON
- AMPHOTÈRE CORPS
- BASE, chimie
- CONSTANTE DE DISSOCIATION
- EAU, physico-chimie
- CATALYSEURS
- HYDRURES
- CHIMIQUES INDUSTRIES
- AMMONIACATES
- GAZ DE FOURS
- OXYDATION
- RÉACTEUR CHIMIQUE
- URÉE
- RÉDUCTEUR, chimie
- COMPRESSEURS
- SCHWEITZER LIQUEUR DE
- NITROJECTION
- CARBOCHIMIE & PÉTROCHIMIE
- EXOTHERMIQUE RÉACTION
- AMMONIAQUE
- AMIDURES
- AMMINES
- ÉCHANGEUR DE CHALEUR
- GAZEUX ÉTAT
- DÉSULFURATION
- AZOTE ATMOSPHÉRIQUE
- CYANHYDRIQUE ACIDE
- NITRATES
- CHIMIE HISTOIRE DE LA
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- GAZ DE SYNTHÈSE