AMMONIAC
Production d'ammoniac
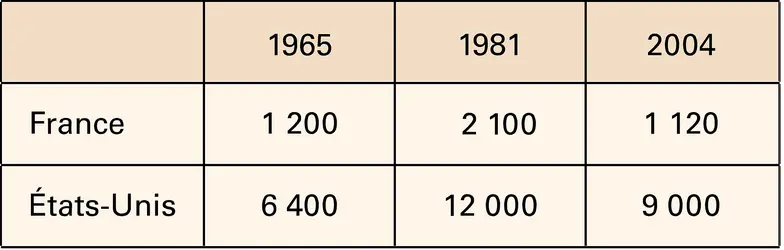
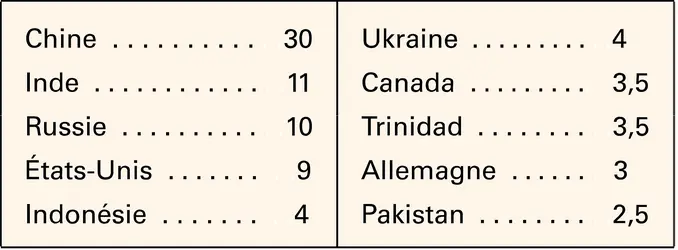
L'ammoniac, fixé à l'état de sulfate ou de phosphate d'ammonium lors du traitement des gaz de fours à coke, ne représente qu'un faible pourcentage de l'ammoniac préparé par synthèse directe ; celui-ci constitue donc la base de l'industrie des engrais azotés. Il s'agit là d'une fabrication très importante et en pleine expansion ; sa production annuelle mondiale était en effet de l'ordre de 100 millions de tonnes au milieu de la décennie 1990 et, en France comme aux États-Unis, les tonnages d'ammoniac produits, toujours exprimés en tonnes d'azote, ont sensiblement doublé de 1958 à 1965, puis de 1965 à 1981. Depuis lors, la production a diminué aux États-Unis (7,8 millions de tonnes d'azote en 2008), tandis qu'en France, après s'être maintenue fixe, elle a diminué pour atteindre seulement 1,35 million de tonnes en 2008. L'ammoniac, produit à partir de gaz naturel, est de plus en plus fabriqué et exporté par les pays producteurs de cette matière première et, en particulier, par la Chine, par la Russie, l'Indonésie, les pays du Golfe....
La synthèse de l'ammoniac repose sur la réaction équilibrée :
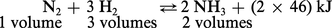
Soulignons que de tels taux de transformation, qui correspondent à l'établissement de l'équilibre, sont très éloignés de ceux que l'on peut prétendre obtenir dans un réacteur industriel, dans lequel les gaz ne séjournent qu'un temps déterminé, appelé durée de contact ; la nécessité d'adopter des températures suffisamment basses pour que le taux de transformation soit encore satisfaisant exige, compte tenu de la lenteur avec laquelle s'opère alors la réaction, l'emploi d'un catalyseur. On est donc amené à travailler sous pression vers 400-500 0C en présence de fer, activé par des promoteurs (alumine et oxyde de potassium).
F. Haber, qui, en collaboration avec Carl Bosch, a mis au point au début du xxe siècle la synthèse industrielle, opérait sous 250 bars (1 bar = 105 Pa). Georges Claude, qui a réalisé cette synthèse en France en 1917, a adopté des hyperpressions de 1 000 bars. Par la suite, divers procédés (Fauser, Casale) ont utilisé des pressions intermédiaires de 400 à 600 bars qui, combinées à une température de l'ordre de 400-500 0C, permettent d'atteindre des taux de transformation de l'ordre de 20-25 p. 100 ; on sépare par liquéfaction l'ammoniac des gaz n'ayant pas réagi et l'on recycle ceux-ci.
La nouvelle tendance consiste à opérer sous des pressions plus faibles et les six nouvelles unités de 1 000 tonnes par jour qui ont été construites en France entre 1965 et 1990, travaillent sous des pressions qui ne dépassent pas 150 à 250 bars.
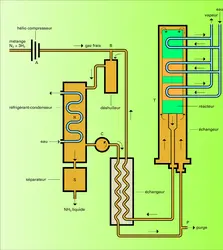
Si les modes de préparation du mélange gazeux peuvent être assez différents d'une usine à l'autre, même lorsqu'elles utilisent la même matière première (le gaz naturel, par exemple), les ateliers de synthèse sont beaucoup plus comparables entre eux ; ils comportent tous une boucle de synthèse dont le fonctionnement est indiqué sur la figure, qui schématise la boucle d'un atelier Fauser. Un mélange gazeux purifié et comprimé (A) est mélangé en B aux gaz sortant du tube de synthèse. Le gaz résultant, déshuilé, traverse le réfrigérant-condenseur R. L'ammoniac liquide, qui se sépare en S, dissout les faibles quantités d'argon introduit avec l'azote, et le méthane provenant de l'hydrogénation de traces de monoxyde de carbone présent dans le mélange gazeux. Les gaz saturés d'ammoniac passent dans l'échangeur E où ils s'échauffent en refroidissant les gaz issus du tube T ; puis, après avoir[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri GUÉRIN : ingénieur de l'École supérieure de physique et chimie industrielles, professeur honoraire de l'université de Paris-XI
Classification
Pour citer cet article
Henri GUÉRIN. AMMONIAC [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER, Pierre SOUCHAY
- 12 364 mots
- 7 médias
La structure de l'ammoniac liquide, qui bout à — 33 0C, rappelle beaucoup celle de l'eau, en raison de l'existence de liaisons hydrogène. Il s'ionise suivant :Ke = [NH4+][NH2—]est de l'ordre de 3 × 10—33. La limite inférieure de l'échelle d'acidité est par...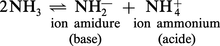
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 350 mots
- 4 médias
L'ammoniac s'additionne sur les aldéhydes, en formant un hémiaminal instable, qui se déshydrate en donnant une aldimine, généralement trimère. Le méthanal réagit d'une manière particulière avec l'ammoniac : la formaldimine, initialement formée, se condense avec deux molécules de méthanal en un composé... -
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
L' alkylation de l'ammoniac par les halogénures d'alkyle en solution aqueuse ou alcoolique est la méthode proposée en 1850 par A. W. von Hofmann pour leur préparation. Cette réaction conduit à un mélange de dérivés primaires, secondaires et tertiaires, ainsi qu'à l'halogénure d'ammonium quaternaire.... -
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 165 mots
- 6 médias
- Afficher les 23 références
Voir aussi
- SELS
- NITRATATION
- NEUTRALISATION, chimie
- HYDROLYSE
- HYDROGÈNE LIAISON
- AMPHOTÈRE CORPS
- BASE, chimie
- CONSTANTE DE DISSOCIATION
- EAU, physico-chimie
- CATALYSEURS
- HYDRURES
- CHIMIQUES INDUSTRIES
- AMMONIACATES
- GAZ DE FOURS
- OXYDATION
- RÉACTEUR CHIMIQUE
- URÉE
- RÉDUCTEUR, chimie
- COMPRESSEURS
- SCHWEITZER LIQUEUR DE
- NITROJECTION
- CARBOCHIMIE & PÉTROCHIMIE
- EXOTHERMIQUE RÉACTION
- AMMONIAQUE
- AMIDURES
- AMMINES
- ÉCHANGEUR DE CHALEUR
- GAZEUX ÉTAT
- DÉSULFURATION
- AZOTE ATMOSPHÉRIQUE
- CYANHYDRIQUE ACIDE
- NITRATES
- CHIMIE HISTOIRE DE LA
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- GAZ DE SYNTHÈSE