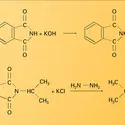
AMMONIAC
Bibliographie
Ammoniac, Centre de documentation, de recherche et d'expérimentation sur les pollutions accidentelles des eaux, Plouzané, 1990
H. Guérin, La Grande Industrie chimique de base, Armand Colin, Paris, 1960 ; Bases techniques et économiques de la chimie industrielle, Eyrolles, Paris, 1974
J.-P. Mazaud, « Les Économies d'énergie dans la production d'ammoniac », in Information-Chimie, no 188, p. 139, 1979
S. Strelzoff, Technology and Manufacture of Ammonia, Wiley Interscience, New York, 1981
K. Weissermel & H. J. Arpe, Chimie organique industrielle, Masson, 1981.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri GUÉRIN : ingénieur de l'École supérieure de physique et chimie industrielles, professeur honoraire de l'université de Paris-XI
Classification
Pour citer cet article
Henri GUÉRIN. AMMONIAC [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER, Pierre SOUCHAY
- 12 364 mots
- 7 médias
La structure de l'ammoniac liquide, qui bout à — 33 0C, rappelle beaucoup celle de l'eau, en raison de l'existence de liaisons hydrogène. Il s'ionise suivant :Ke = [NH4+][NH2—]est de l'ordre de 3 × 10—33. La limite inférieure de l'échelle d'acidité est par...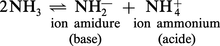
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 350 mots
- 4 médias
L'ammoniac s'additionne sur les aldéhydes, en formant un hémiaminal instable, qui se déshydrate en donnant une aldimine, généralement trimère. Le méthanal réagit d'une manière particulière avec l'ammoniac : la formaldimine, initialement formée, se condense avec deux molécules de méthanal en un composé... -
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
L' alkylation de l'ammoniac par les halogénures d'alkyle en solution aqueuse ou alcoolique est la méthode proposée en 1850 par A. W. von Hofmann pour leur préparation. Cette réaction conduit à un mélange de dérivés primaires, secondaires et tertiaires, ainsi qu'à l'halogénure d'ammonium quaternaire.... -
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 165 mots
- 6 médias
- Afficher les 23 références
Voir aussi
- SELS
- NITRATATION
- NEUTRALISATION, chimie
- HYDROLYSE
- HYDROGÈNE LIAISON
- AMPHOTÈRE CORPS
- BASE, chimie
- CONSTANTE DE DISSOCIATION
- EAU, physico-chimie
- CATALYSEURS
- HYDRURES
- CHIMIQUES INDUSTRIES
- AMMONIACATES
- GAZ DE FOURS
- OXYDATION
- RÉACTEUR CHIMIQUE
- URÉE
- RÉDUCTEUR, chimie
- COMPRESSEURS
- SCHWEITZER LIQUEUR DE
- NITROJECTION
- CARBOCHIMIE & PÉTROCHIMIE
- EXOTHERMIQUE RÉACTION
- AMMONIAQUE
- AMIDURES
- AMMINES
- ÉCHANGEUR DE CHALEUR
- GAZEUX ÉTAT
- DÉSULFURATION
- AZOTE ATMOSPHÉRIQUE
- CYANHYDRIQUE ACIDE
- NITRATES
- CHIMIE HISTOIRE DE LA
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- GAZ DE SYNTHÈSE