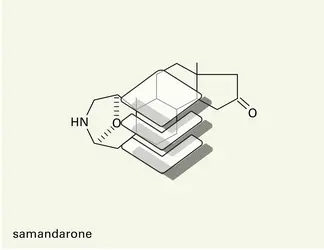
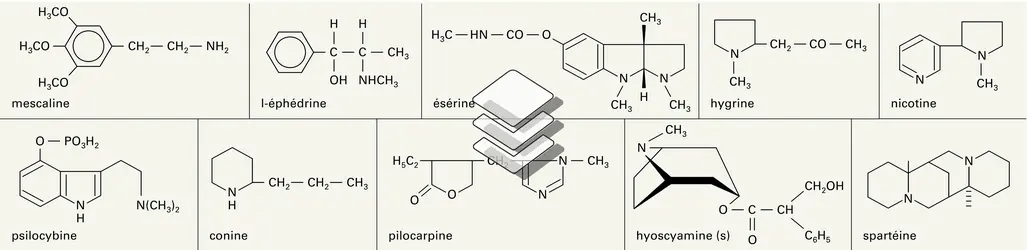
ALCALOÏDES
- 1. Historique
- 2. Origine et répartition naturelle
- 3. Chimiotaxonomie
- 4. Localisation
- 5. Biotechnologie
- 6. Structure et classification chimique
- 7. Propriétés physico-chimiques
- 8. Réactifs généraux des alcaloïdes
- 9. Extraction et purification
- 10. Dosage
- 11. Détermination de la structure
- 12. Synthèse
- 13. Rôle dans les organismes d'origine
- 14. Biogenèse
- 15. Intérêt thérapeutique
- 16. Propriétés et utilisations diverses
- 17. Bibliographie
Détermination de la structure
Il n'existe pas de procédés propres à cette catégorie de substances naturelles, et il est fait appel à l'ensemble des méthodes physiques maintenant classiques. Elles permettent, sur de faibles quantités de produit, et en quelques semaines, voire quelques jours ou heures, d'établir la structure spatiale exacte de la molécule. À titre de comparaison, l'établissement de la formule de la strychnine a demandé plus d'un siècle et consommé des kilogrammes de produit !
Dans un premier temps, on détermine la masse moléculaire et la formule élémentaire brute de forme CxHyOzNp par microanalyse ou spectrométrie de masse à haute résolution. Le spectre d'absorption dans l'U.V. ou le visible (spectre électronique) fournit des indications sur certains éléments structuraux ou « chromophores » comportant des électrons engagés dans des liaisons multiples et des cycles « aromatiques ». Le tracé obtenu – coefficient d'absorption, ou absorbance, en fonction de la longueur d'onde du rayonnement – est parfois suffisamment caractéristique pour identifier le type structural, comme dans le cas des alcaloïdes indoliques ou isoquinoléiques. Le spectre d'absorption dans l'infrarouge (I.R.) est lié aux différentes liaisons interatomiques de l'édifice moléculaire en décelant surtout les « vibrations de valence » (OH, NH, CO, CN, C=C, liaisons des cycles aromatiques). Le spectre de résonance magnétique nucléaire ( R.M.N.) détecte sélectivement certains noyaux atomiques comme 1H, 2H, 13C, 15N, 18O. Il est très utile pour « ausculter » les protons 1H qui fournissent dans le spectre des signaux distincts en fonction de leur environnement moléculaire et de leur orientation spatiale. On détermine ainsi, avec une relative précision, les groupements fonctionnels hydrogénés (méthyles CH3 liés à C, N ou O ; −CH= ; >NH ; CH des noyaux aromatiques) et leur proximité, grâce au phénomène du couplage entre protons voisins, analysable par des techniques avec appui informatique. L'isotope prépondérant du carbone, constituant obligatoire des substances organiques, est le noyau 12C qui ne donne pas lieu au phénomène de R.M.N. Il y a donc lieu de s'adresser à l'isotope 13C naturellement peu abondant (1,1 p. 100) mais, avec l'apparition d'appareils à hautes performances, il est possible, de la même façon que pour le proton, de déterminer l'environnement de chaque atome de carbone d'une molécule et de le localiser. La R.M.N. de 13C est ainsi devenue une méthode irremplaçable de détermination de l'enchaînement carboné d'un alcaloïde, c'est-à-dire de son squelette moléculaire, souvent même avec sa configuration spatiale. Le spectre de masse est fondé sur l'ionisation d'une molécule dans le vide par divers agents (bombardement d'électrons ou d'ions, champ électrique). Si cette ionisation est suffisamment énergétique, elle s'accompagne d'une fragmentation de la molécule, caractéristique de sa structure et donnant naissance à des ions secondaires qui sont triés en fonction de leur rapport masse/charge électrique (m/z). C'est l'enregistrement de tous les ions ainsi formés qui constitue le spectre de masse. Son dépouillement met en évidence divers enchaînements atomiques, sorte de puzzle qui permet de remonter à la structure du produit, mais cette opération est souvent difficile. En outre, le spectre met en évidence la molécule simplement ionisée sous forme d'un « ion moléculaire » dont la détermination exacte de la masse apparente avec plusieurs décimales donne directement la formule élémentaire (CxHyOzNp), et cela avec moins de 1 milligramme de produit.
L'interprétation cohérente de l'ensemble des données fournies par les méthodes précédentes permet en général de trouver la[...]
- 1. Historique
- 2. Origine et répartition naturelle
- 3. Chimiotaxonomie
- 4. Localisation
- 5. Biotechnologie
- 6. Structure et classification chimique
- 7. Propriétés physico-chimiques
- 8. Réactifs généraux des alcaloïdes
- 9. Extraction et purification
- 10. Dosage
- 11. Détermination de la structure
- 12. Synthèse
- 13. Rôle dans les organismes d'origine
- 14. Biogenèse
- 15. Intérêt thérapeutique
- 16. Propriétés et utilisations diverses
- 17. Bibliographie
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques E. POISSON : professeur à l'université de Paris-Sud, Centre d'études pharmaceutiques de Châtenay-Malabry
Classification
Pour citer cet article
Jacques E. POISSON. ALCALOÏDES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACONITINE
- Écrit par Philippe COURRIÈRE
- 374 mots
L'aconit, renonculacée, se récolte, en France notamment, dans les régions marécageuses et en montagne. Pour extraire l'aconitine, la racine séchée et pulvérisée est épuisée par une solution alcoolique d'acide tartrique ; on élimine l'alcool par distillation, on met le tartrate d'aconitine en solution...
-
ANESTHÉSIE
- Écrit par Francis BONNET, François CHAST
- 4 117 mots
- 2 médias
En 1860, à Göttingen, Albert Niemann (1834-1861) isola, à partir d'un extrait de feuilles de coca, un alcaloïde qu'il baptisa cocaïne et qui fut considéré comme un simple stimulant, voisin de la caféine. À Vienne, Carl Koller et Sigmund Freud avaient constaté que les cristaux de cocaïne... -
ATROPINE
- Écrit par Universalis
- 415 mots
Substance cristalline, toxique, appartenant à la classe des alcaloïdes. On l'obtient à partir de la L-hyociamine qui est un composant de plantes de la famille des Solanaceae telles que la belladone (Atropa), la jusquiame et le datura. Elle est très soluble dans l'eau. Elle forme une série...
-
BELLADONE
- Écrit par Philippe COURRIÈRE
- 377 mots
De la famille des solanacées, la belladone (Atropa belladona) est une plante annuelle, vivace, pouvant atteindre un mètre de hauteur. On en utilise les feuilles, cueillies au moment de la floraison car la teneur en principes actifs y est la plus forte, ainsi que la racine, ramassée en automne...
- Afficher les 43 références
Voir aussi
- PERVENCHE
- POISON
- RÉACTIF, chimie
- ERGOT DE SEIGLE
- RMN (résonance magnétique nucléaire), physico-chimie
- SCIENCES HISTOIRE DES, XIXe s.
- DOSAGE, chimie
- EXTRACTION, chimie
- PURIFICATION, physico-chimie
- TAXINOMIE ou TAXONOMIE
- CHLORPROMAZINE
- VINCRISTINE
- VINCAMINE
- COLCHICINE
- BIOSYNTHÈSES
- SERTÜRNER FRIEDRICH WILHELM (1783-1841)
- STRYCHNINE
- LSD (diéthylamide de l'acide lysergique)
- VINBLASTINE
- ERGOTAMINE
- CHIMIE HISTOIRE DE LA
- MOLÉCULES BIOLOGIQUES, structure et fonction
- SPECTRE D'ABSORPTION
- TAXINOMIE ou TAXONOMIE BIOLOGIQUE