ACIDES & BASES
Conclusion
Les considérations précédentes montrent les avantages de la généralisation de la notion d'acide et de base. On a proposé une généralisation encore plus grande et, en 1939, Usanovich, assimilant les électrons à des anions, montra que les réactions d'oxydoréduction deviennent une partie indissociable des phénomènes acidobasiques. Cette idée, très satisfaisante sur le plan théorique, a le défaut de faire de l'acidité une notion trop générale pour s'appliquer dans la pratique.
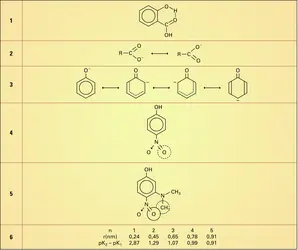
Si l'on compare les définitions de Brønsted et de Lewis, on remarque qu'en général les bases de Lewis sont également des bases de Brønsted puisqu'elles sont capables de se fixer sur le proton ; naturellement, la définition de Lewis est plus générale, car une base de Lewis est capable de fournir un doublet à d'autres particules que le proton (cf. supra Ag—NH3).
En ce qui concerne les acides, il y a quelque divergence entre les deux théories :
– BF3, Ag+ ne sont pas des acides de Brønsted, puisqu'ils ne peuvent fournir de protons ;
– H3PO4 n'est pas un acide de Lewis, pas plus que H3O+, car aucune place n'est accessible à une paire d'électrons.
Pour mettre d'accord le langage des deux théories, Bjerrum (1951) a proposé un compromis, au prix de l'introduction d'un vocable nouveau :
a) Une base est un accepteur de protons ou un donneur d'une paire d'électrons ;
b) Un acide est un donneur de protons ;
c) Une antibase est un accepteur de base ou d'une paire d'électrons.
D'ailleurs Izmaïlov prouva, vers 1955, que les réactions acidobasiques en solution sont beaucoup plus complexes que ne l'admettrait Brønsted ; au cours de la neutralisation, il se forme d'abord un composé moléculaire entre l'acide et la base (l'un des deux partenaires pouvant être une molécule de solvant).
Ce composé résulte en fait de l'établissement d'une liaison hydrogène entre l'atome H de l'acide et l'atome donneur d'électrons de la base ; l'existence de telles liaisons a été prouvée par cryoscopie et spectroscopie Raman.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Yves GAUTIER
: docteur en sciences de la Terre, concepteur de la collection
La Science au présent à la demande et sous la direction d'Encyclopædia Universalis, rédacteur en chef de 1997 à 2015 - Pierre SOUCHAY : professeur à l'université de Paris-VI-Pierre-et-Marie Curie et à l'École nationale supérieure de chimie, Paris
Classification
Pour citer cet article
Yves GAUTIER et Pierre SOUCHAY. ACIDES & BASES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 111 mots
- 3 médias
L'acide acétique, acide organique de formule CH3COOH, est le membre le plus important de la famille des acides carboxyliques. Il joue avec ses dérivés un rôle essentiel dans de nombreuses synthèses et dégradations biologiques accompagnant le métabolisme des aliments et la formation des tissus....
-
ACIDES-ALCOOLS
- Écrit par Jacques METZGER
- 1 300 mots
- 1 média
Un acide-alcool est une molécule renfermant au moins une fonction acide carboxylique et une fonction alcool.
La nature nous en fournit de nombreux exemples : acides lactique du lait aigri, malique des pommes avant maturité (diacide-monoalcool), tartrique du tartre des vins (diacide-diacool), citrique...
-
ALCOOLS
- Écrit par Jacques METZGER
- 5 832 mots
- 8 médias
Lafonction alcool présente à la fois un caractère acide et un caractère basique. Son acidité se manifeste lorsqu'il est mis au contact d'une base : le proton est cédé à cette dernière et l'anion alcoolate formé ainsi que l'acide conjugué de la base se trouvent en équilibre avec l'alcool non dissocié... -
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 350 mots
- 4 médias
Les principales méthodes de préparation des dérivés carbonylés mettant en œuvre la réduction du substrat concernent les acides et les fonctions dérivées. - Afficher les 40 références
Voir aussi
- PHOSGÈNE (oxychlorure de carbone)
- ANHYDRIDE SULFUREUX ou DIOXYDE DE SOUFRE
- SELS
- NEUTRALISATION, chimie
- DISSOCIATION IONIQUE
- OSTWALD LOI DE DILUTION D'
- IONS
- HYDROLYSE
- INDICATEURS COLORÉS
- ÉLECTRONÉGATIVITÉ
- HYDROGÈNE LIAISON
- EAU-FORTE
- LEWIS THÉORIE DE
- ÉLECTROPHILES RÉACTIONS
- IZMAÏLOV RUSTUM GADJIEVITCH (1909- )
- COORDINENCE ou NOMBRE DE COORDINATION
- ALCALI
- pK
- RÉACTIONNELS MÉCANISMES
- BRØNSTED-LOWRY THÉORIE DE
- AMPHOTÈRE CORPS
- AMPHOLYTE
- VINAIGRE
- PYROSULFURIQUE ACIDE
- BJERRUM NIELS (1879-1958)
- BASE, chimie
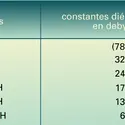
- CONSTANTE DE DISSOCIATION
- IONISATION
- EAU, physico-chimie
- FORCE D'UN ACIDE ou D'UNE BASE
- ÉQUILIBRE, chimie
- CATALYSEURS
- HYDROXYLE ou OXHYDRYLE
- ADDITION, chimie
- POLARISATION, chimie
- CONCENTRATION, chimie
- AMIDURES
- ÉCHANGE CHIMIQUE
- CONSTANTE DIÉLECTRIQUE
- NUCLÉOPHILES SUBSTITUTIONS
- NATRON
- pH
- AUTOPROTOLYSE RÉACTION D'
- STÉRIQUE EFFET ou EMPÊCHEMENT
- CHIMIE HISTOIRE DE LA
- SOLUTION, chimie
- PLUIES ACIDES
- DÉPLACEMENT CHIMIQUE
- CONSTANTE D'ÉQUILIBRE, chimie
- ACIDITÉ ÉCHELLE D'
- DONNEUR, chimie
- ACCEPTEUR, chimie
- PEARSON RALPH GOTTFRIED (1919- )