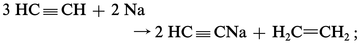ACÉTYLÈNE
L'acétylène, de formule brute C2H2, est le premier terme des alcynes ou hydrocarbures acétyléniques de formule générale CnH2n-2. Ces derniers sont caractérisés par la présence d'une triple liaison (− C ≡ C−) dans leur molécule. L'acétylène présente une très grande réactivité. À côté du rôle important qu'il joue comme combustible dans le chalumeau oxyacétylénique, son utilisation, en tant que matière première, dans un grand nombre de synthèses industrielles, est devenue prépondérante. Le développement de sa production, liée initialement à celle du carbure de calcium, a su s'en libérer par la mise au point de divers procédés de craquage du gaz naturel ou d'essences. Leur extension risque toutefois d'être freinée par le fait que l'acétylène est de plus en plus concurrencé par d'autres matières premières, notamment par l'éthylène, dans divers procédés très importants.
Historique
Isolé, semble-t-il, dès 1836 par E. Davy, préparé en 1860 par M. Berthelot, qui lui donne son nom et l'étudie, l'acétylène ne devait devenir un produit courant qu'après que H. Moissan et T. L. Willson eurent préparé, en 1892, indépendamment l'un de l'autre, du carbure de calcium au four à arc, four inventé par H. Davy dès 1801, mais développé industriellement par Siemens à partir de 1877.
Quelques années plus tard, le carbure de calcium était obtenu industriellement en France, en Allemagne, aux États-Unis, en Italie, en Suisse... et, dès 1900, de très nombreux générateurs d'acétylène étaient décrits, en vue de l'utilisation de ce gaz dans les brûleurs, pour l'éclairage.
Divers accidents, ainsi que les travaux de Berthelot et P. Vieille qui démontraient la quasi-impossibilité pratique de liquéfier et de comprimer l'acétylène, risquaient de limiter son utilisation lorsque G. Claude et Hess, en 1897, en découvrant sa grande solubilité dans l'acétone, trouvèrent un moyen de le transporter. H. Le Châtelier ayant proposé de le comprimer dans des tubes contenant une matière poreuse, Janet suggéra d'ajouter de telles matières dans les tubes chargés en acétone.
L'acétylène arrivait un peu tard pour remplacer dans l'éclairage public le gaz de ville dont l'utilisation avait été révolutionnée en 1886 par l'emploi du manchon dû à Auer von Welsbach ; si, en 1910, un millier de villes avaient adopté l'acétylène, le développement de l'éclairage électrique allait s'opposer à l'extension de cette utilisation.
L'emploi du chalumeau oxyacétylénique, mis au point par Picard et dont l'intérêt avait été mis en évidence par Le Châtelier dès 1895, allait en revanche rapidement prendre de l'extension, lorsque les travaux de Linde et de Claude eurent fourni la possibilité d'extraire facilement l'oxygène de l'air. La préparation de solvants chlorés : trichloréthylène et perchloréthylène, entreprise dès 1910 en Allemagne, ne devait surtout se développer en France et dans les autres pays qu'après la Première Guerre mondiale, offrant ainsi un débouché aux usines de chlore installées pendant cette période critique.
En s'introduisant dans l'industrie du chlore, l'acétylène amorçait un rapprochement entre chimie minérale et chimie organique... La transformation du carbure en aldéhyde et en acide acétique, entreprise en Allemagne durant la guerre, confirmait cette orientation de la chimie industrielle moderne.
Après la mise au point, depuis 1930, de la synthèse à partir de l'acétylène, de divers élastomères, Buna (Allemagne), G.R.S. et Néoprène (États-Unis), Sovprène (U.R.S.S.), dont la Seconde Guerre mondiale devait développer la production, la fabrication de résines vinyliques (acétate et chlorure), de vinylidène, d'acrylonitrile[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri GUÉRIN : ingénieur de l'École supérieure de physique et chimie industrielles, professeur honoraire de l'université de Paris-XI
Classification
Médias
Autres références
-
ALCYNES
- Écrit par Jacques METZGER
- 3 301 mots
- 5 médias
-
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 165 mots
- 6 médias
-
HYDROCARBURES
- Écrit par Pierre LASZLO
- 4 523 mots
- 4 médias
La molécule d'acétylène (ou éthyne) C2H2 s'obtient, d'une part en faisant réagir le carbure de calcium C2Ca et l'eau, d'autre part et majoritairement par le procédé B.A.S.F., inventé durant les décennies 1920 et 1930, à partir de gaz naturel et d'autres hydrocarbures issus du pétrole.... -
JUPITER, planète
- Écrit par André BOISCHOT , André BRAHIC , Encyclopædia Universalis , Daniel GAUTIER , Guy ISRAËL et Pierre THOMAS
- 11 281 mots
- 60 médias
...10 p. 100 d' hélium. S'y ajoutent une petite quantité de méthane (CH4) – de l'ordre de 0,1 p. 100 – et des quantités encore plus faibles d'acétylène (C2H2) et d'éthane (C2H6) ; ces deux derniers gaz sont produits dans la haute atmosphère par le rayonnement ultraviolet solaire,... - Afficher les 10 références