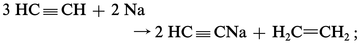ACÉTYLÈNE
Le problème de l'acétylène
Les baisses de production indiquées plus haut s'expliquent par la concurrence de l'éthylène, fourni par des installations de plus en plus nombreuses de craquage à la vapeur d'essences légères et qui se substitue à l'acétylène du fait de son prix de revient moins élevé. Le chlorure de vinyle, gros débouché de l'acétylène, est maintenant obtenu par craquage du dichloréthane, préparé lui-même par oxychloration de l'éthylène. Si le trichloréthylène est encore fabriqué à partir de l'acétylène, le perchlorétylène résulte principalement aujourd'hui de la chloration des mélanges propane-propène obtenus en raffinerie. L'acide acétique qui, par l'intermédiaire de l'aldéhyde acétique, a constitué le premier produit de synthèse à partir de l'acétylène, tend à être obtenu, soit à partir de l'éthylène (procédé Wacker), soit par oxydation des essences légères (procédé de la Distillers). L'acétate de vinyle est préparé à partir de 1964, aux États-Unis et en Grande-Bretagne, par action de l'acide acétique sur un mélange d'éthylène et d'oxygène en présence de catalyseur.
Dans l'obtention de l' acrylonitrile, matière première du caoutchouc A.B.S. (acrylonitrile, butadiène, styrène), l'acétylène (qui avait supplanté depuis 1950 l'oxyde d'éthylène) tend à être remplacé par le propylène que l'on oxyde en présence d'ammoniac. Enfin un nouveau procédé appliqué par Plastogil substitue à l'acétylène le butadiène comme matière première du Néoprène.
Cette régression de l'acétylène à l'avantage de l'éthylène est-elle définitive ? Il serait imprudent de l'affirmer. En effet l'éthylène est obtenu au départ de produits pétroliers dont le prix augmente, alors qu'une baisse du prix du charbon d'une part et du kilowatt-heure (que l'on peut envisager avec les centrales nucléaires) pourrait retourner la situation.
Notons que, dans des conditions économiques particulières, l'Afrique du Sud, continuant à fabriquer l'acétylène à partir du carbure, a mis en route en 1978 une unité de 100 000 t/an de chlorure de vinyle, au départ d'acétylène ex-carbure.
Il convient enfin de noter que les synthèses de carbonylation de Reppe ont servi principalement pour faire des acrylates ; ce procédé est devenu obsolète.
Un renouveau du développement de la production de l'acétylène ne doit néanmoins pas être écarté.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri GUÉRIN : ingénieur de l'École supérieure de physique et chimie industrielles, professeur honoraire de l'université de Paris-XI
Classification
Pour citer cet article
Henri GUÉRIN. ACÉTYLÈNE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALCYNES
- Écrit par Jacques METZGER
- 3 301 mots
- 5 médias
-
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 165 mots
- 6 médias
-
HYDROCARBURES
- Écrit par Pierre LASZLO
- 4 523 mots
- 4 médias
La molécule d'acétylène (ou éthyne) C2H2 s'obtient, d'une part en faisant réagir le carbure de calcium C2Ca et l'eau, d'autre part et majoritairement par le procédé B.A.S.F., inventé durant les décennies 1920 et 1930, à partir de gaz naturel et d'autres hydrocarbures issus du pétrole.... -
JUPITER, planète
- Écrit par André BOISCHOT, André BRAHIC, Universalis, Daniel GAUTIER, Guy ISRAËL, Pierre THOMAS
- 11 281 mots
- 60 médias
...10 p. 100 d' hélium. S'y ajoutent une petite quantité de méthane (CH4) – de l'ordre de 0,1 p. 100 – et des quantités encore plus faibles d'acétylène (C2H2) et d'éthane (C2H6) ; ces deux derniers gaz sont produits dans la haute atmosphère par le rayonnement ultraviolet solaire,... - Afficher les 10 références
Voir aussi
- CHLORURE DE VINYLE
- NÉOPRÈNES
- ÉTHYLÈNE
- CHIMIQUES INDUSTRIES
- CARBURE DE CALCIUM
- OXYACÉTYLÉNIQUE CHALUMEAU
- EXPLOSIVES SUBSTANCES
- TRIPLE LIAISON ou LIAISON ACÉTYLÉNIQUE
- ADDITION, chimie
- ÉTHYNYLATION
- CRAQUAGE ou CRACKING, chimie
- AUTOTHERMIQUE PROCÉDÉ
- ACÉTYLURES
- ARC PROCÉDÉ À L'
- ACRYLONITRILE
- TRICHLORÉTHYLÈNE
- PERCHLORÉTHYLÈNE
- VINYLATION
- WULFF PROCÉDÉ
- PURIFICATION, physico-chimie
- ENDOTHERMIQUE RÉACTION
- CHAUX (oxyde et hydroxyde de calcium)
- GAZEUX ÉTAT
- BASF (Badische Anilin und Soda Fabrik) PROCÉDÉ
- GAZOMÈTRE
- BUTANEDIOL