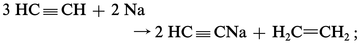ACÉTYLÈNE
Préparations
La synthèse de l'acétylène réalisée par Berthelot, en faisant éclater l'arc électrique dans de l'hydrogène (expérience classique de l'œuf électrique), n'a pas eu de conséquence pratique si ce n'est qu'elle a montré que l'acétylène formé à haute température devait être trempé (c'est-à-dire refroidi brusquement) si on voulait l'amener sans décomposition à la température ordinaire. On devait tenir compte de cette observation lorsque, entre les deux guerres, on a mis au point la préparation de l'acétylène par craquage d'hydrocarbures. Jusque-là l'acétylène était obtenu à partir du carbure de calcium, dont l'industrie s'est considérablement développée du fait des demandes croissantes en acétylène. Cette fabrication exigeant une grosse consommation d'énergie électrique, on a tenté d'y remédier en le préparant au départ du méthane ou d'essence.
Cette substitution de matière première, apparue vers 1938 en Allemagne, où 40 p. 100 environ de l'acétylène étaient obtenus dès 1965 à partir de méthane ou d'essences légères, risque d'être éphémère : l'éthylène résultant du « craquage à la vapeur » d'essences tend en effet de plus en plus à se substituer à l'acétylène.
Préparation de l'acétylène par hydrolyse du carbure de calcium
L'hydrolyse du carbure de calcium selon la réaction :
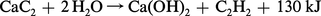
Étant donné la composition moyenne du carbure de calcium (80 à 82 p. 100 de CaC2), elle exige environ 500 g d'eau par kg de carbure et fournit 300 l d'acétylène et 1 100 g de chaux, tandis qu'il se dégage environ 1 800 kJ, quantité de chaleur considérable, qui entraînerait la polymérisation de l'acétylène si elle n'était pas en grande partie dissipée.
La préparation de l'acétylène s'opère dans des générateurs qui sont de deux types : humides ou secs selon que l'on extrait la chaux formée à l'état d'un lait à environ 10 p. 100, ou bien à l'état de chaux hydratée quasiment sèche.
Les générateurs humides
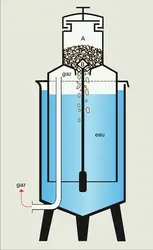
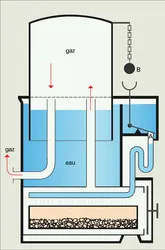
Les générateurs humides sont les plus utilisés par les producteurs d'acétylène. De divers types, ils dérivent des lampes à acétylène dont d'innombrables modèles ont été brevetés (6 000 brevets d'inventions en France entre 1895 et 1941), mais qui se ramènent quant à leur fonctionnement à trois catégories : générateurs à chute de carbure dans l'eau, générateurs à chute d'eau, générateurs à contact dont les figures indiquent le principe.
Les générateurs à chute d'eau, dont la capacité de production peut atteindre 2 500 mètres cubes par heure, sont les plus utilisés dans les ateliers de production d'acétylène dissous. Ils sont en relation avec un gazomètre intermédiaire formant volant, un système d'épuration et un dispositif de remplissage des bouteilles.
Les générateurs secs
Les générateurs secs ont été mis au point en Allemagne, pour la production de l'acétylène utilisé comme matière première de l'industrie chimique. Compte tenu de la réaction d'hydrolyse du carbure, la chaleur dégagée permet d'évaporer environ 600 g d'eau par kg de carbure, de telle sorte qu'on peut ajouter un kg d'eau par kg de carbure si l'on veut obtenir de la chaux hydratée sèche.
Divers générateurs secs sont utilisés : celui de la Shaw Chemicals Ltd. (Canada) installé notamment à Saint-Auban permet de traiter 4 à 5 t/h de carbure 0-7 mm. Il comporte essentiellement trois cylindres superposés dans lesquels s'opère la décomposition complète du carbure et deux tours assurant le lavage du gaz. L'acétylène produit passe dans un gazomètre dont les déplacements peuvent, dans les générateurs humides, régler l'admission du carbure.[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri GUÉRIN : ingénieur de l'École supérieure de physique et chimie industrielles, professeur honoraire de l'université de Paris-XI
Classification
Pour citer cet article
Henri GUÉRIN. ACÉTYLÈNE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALCYNES
- Écrit par Jacques METZGER
- 3 301 mots
- 5 médias
-
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 165 mots
- 6 médias
-
HYDROCARBURES
- Écrit par Pierre LASZLO
- 4 523 mots
- 4 médias
La molécule d'acétylène (ou éthyne) C2H2 s'obtient, d'une part en faisant réagir le carbure de calcium C2Ca et l'eau, d'autre part et majoritairement par le procédé B.A.S.F., inventé durant les décennies 1920 et 1930, à partir de gaz naturel et d'autres hydrocarbures issus du pétrole.... -
JUPITER, planète
- Écrit par André BOISCHOT, André BRAHIC, Universalis, Daniel GAUTIER, Guy ISRAËL, Pierre THOMAS
- 11 281 mots
- 60 médias
...10 p. 100 d' hélium. S'y ajoutent une petite quantité de méthane (CH4) – de l'ordre de 0,1 p. 100 – et des quantités encore plus faibles d'acétylène (C2H2) et d'éthane (C2H6) ; ces deux derniers gaz sont produits dans la haute atmosphère par le rayonnement ultraviolet solaire,... - Afficher les 10 références
Voir aussi
- CHLORURE DE VINYLE
- NÉOPRÈNES
- ÉTHYLÈNE
- CHIMIQUES INDUSTRIES
- CARBURE DE CALCIUM
- OXYACÉTYLÉNIQUE CHALUMEAU
- EXPLOSIVES SUBSTANCES
- TRIPLE LIAISON ou LIAISON ACÉTYLÉNIQUE
- ADDITION, chimie
- ÉTHYNYLATION
- CRAQUAGE ou CRACKING, chimie
- AUTOTHERMIQUE PROCÉDÉ
- ACÉTYLURES
- ARC PROCÉDÉ À L'
- ACRYLONITRILE
- TRICHLORÉTHYLÈNE
- PERCHLORÉTHYLÈNE
- VINYLATION
- WULFF PROCÉDÉ
- PURIFICATION, physico-chimie
- ENDOTHERMIQUE RÉACTION
- CHAUX (oxyde et hydroxyde de calcium)
- GAZEUX ÉTAT
- BASF (Badische Anilin und Soda Fabrik) PROCÉDÉ
- GAZOMÈTRE
- BUTANEDIOL