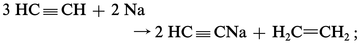ACÉTYLÈNE
- Article mis en ligne le
- Modifié le
- Écrit par Henri GUÉRIN
Productions et utilisations
Le développement considérable des utilisations de l'acétylène qui avait rendu nécessaire l'obtention de ce gaz par craquage du méthane a été interrompu en raison de la concurrence de l'éthylène, que des installations de plus en plus nombreuses, opérant par craquage des essences légères, fournissent à un prix plus avantageux.
C'est ainsi qu'aux États-Unis, qui ont été longtemps le plus important producteur d'acétylène, la firme produisant le plus d'acétylène n'utilise plus ce gaz que pour la fabrication de l'acétate de vinyle et du butane-1,4-diol.
Notons d'ailleurs que la production d'acétylène dans ce pays, qui était passée de 150 000 t en 1945 à plus de 500 000 t en 1965, a notablement diminué puisqu'elle n'atteignait déjà plus que 124 000 t en 1975 et 103 000 t en 1977.
On a observé une baisse comparable dans les autres pays ; ainsi, en Allemagne, on produisait 204 000 t d'acétylène en 1977 contre 346 000 t en 1974.
En France, l'acétylène a pratiquement perdu ses emplois comme matière première de l'industrie chimique. Dissous dans l'acétone ou le diméthylformamide, il a également vu diminuer son utilisation car il est concurrencé par l'emploi du laser pour la soudure autogène : la production est passée de 12 × 106 m3 en 1981 à 8,6 × 1O6 m3 en 1990.
Si l'acétylène, agent de synthèse remarquable, permet la préparation d'un nombre considérable de produits, il convient de souligner spécialement les fabrications dont il peut constituer la matière première.
Indiquons le principe de ces préparations :
Le chlorure de vinyle résultait de l'union directe de l'acétylène et du gaz chlorhydrique sur du charbon de bois imprégné de chlorure mercurique (réaction 3).
On polymérisait ensuite le monomère en émulsion, en suspension ou dans la masse. Le chlorure de vinyle monomère est essentiellement préparé actuellement par oxychloration de l'éthylène.
L'acétaldéhyde obtenu par hydratation de l'acétylène, en présence de sulfate mercurique (réaction 4), est oxydé en acide acétique à 55-65 0C, par l'air, en présence d'acétate de manganèse.
La fixation de l'acide cyanhydrique sur l'acétylène (réaction 3) s'opère en solution de chlorure cuivreux et conduit à l'acrylonitrile.
La préparation des deux solvants chlorés encore les plus importants, trichloréthylène dit « Tri » et perchloréthylène dit « Per », surtout utilisés respectivement pour le dégraissage des métaux et pour le nettoyage à sec, s'opère à partir du tétrachloréthane qui résulte lui-même de la chloration de l'acétylène en phase liquide (pied de cuve de tétrachloréthane) à 80 0C et en présence de sels de fer :

On passe au trichloréthylène par hydrolyse par la chaux à 80 0C ou, de plus en plus, par craquage vers 500 0C :

Par chloration du trichloréthylène en phase liquide on peut préparer le pentachloréthane CHCl2 − CCl3 qui par une hydrolyse comparable à celle du tétrachloréthane fournit le perchloréthylène CCl2=CCl2. Quant au Néoprène, sa préparation à partir de l'acétylène exige la dimérisation de celui-ci en monovinylacétylène et la fixation du gaz chlorhydrique forme du chloroprène (réaction 8), liquide bouillant à 59 0C, qu'on entraîne à la vapeur, puis qu'on purifie par distillation et qu'enfin on polymérise généralement en émulsion.
Le butane-1,4-diol est préparé par réaction de l'acétylène avec une solution aqueuse de formaldéhyde à 30 p. 100, en présence d'acétylure de cuivre :

On obtient du butyne-1,4-diol que l'on hydrogène en phase liquide entre 70 et 100 0C, sous 25 à 30 MPa, en utilisant du nickel de Raney comme catalyseur :

La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri GUÉRIN : ingénieur de l'École supérieure de physique et chimie industrielles, professeur honoraire de l'université de Paris-XI
Classification
Pour citer cet article
Henri GUÉRIN. ACÉTYLÈNE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Médias
Autres références
-
ALCYNES
- Écrit par Jacques METZGER
- 3 301 mots
- 5 médias
-
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 165 mots
- 6 médias
-
HYDROCARBURES
- Écrit par Pierre LASZLO
- 4 523 mots
- 4 médias
La molécule d'acétylène (ou éthyne) C2H2 s'obtient, d'une part en faisant réagir le carbure de calcium C2Ca et l'eau, d'autre part et majoritairement par le procédé B.A.S.F., inventé durant les décennies 1920 et 1930, à partir de gaz naturel et d'autres hydrocarbures issus du pétrole.... -
JUPITER, planète
- Écrit par André BOISCHOT , André BRAHIC , Encyclopædia Universalis , Daniel GAUTIER , Guy ISRAËL et Pierre THOMAS
- 11 281 mots
- 60 médias
...10 p. 100 d' hélium. S'y ajoutent une petite quantité de méthane (CH4) – de l'ordre de 0,1 p. 100 – et des quantités encore plus faibles d'acétylène (C2H2) et d'éthane (C2H6) ; ces deux derniers gaz sont produits dans la haute atmosphère par le rayonnement ultraviolet solaire,... - Afficher les 10 références