CHLORE
Le chlore (symbole Cl, numéro atomique 17) est un élément chimique de la famille des halogènes. Sa molécule Cl2 (le dichlore) est un gaz verdâtre plus lourd que l'air. Irritant et suffocant, il fut employé comme gaz de combat pendant la Première Guerre mondiale. Trop réactif pour exister à l'état libre, le chlore est très répandu dans la nature, dans les eaux salées et les gisements de sel notamment, à l'état d'halogénures. Il est aussi un constituant important de la matière vivante : le sérum sanguin renferme environ 7 grammes de chlorure de sodium par litre.
La production mondiale de chlore a atteint près de trente-sept millions de tonnes en 1989. Sa progression fut très rapide entre 1965 et 1975 mais a ensuite ralenti. L'industrie chimique consomme environ 80 p. 100 du chlore pour la préparation de solvants, de plomb tétraéthyle, de plastiques, de caoutchoucs synthétiques, d'insecticides. L'industrie papetière est un autre utilisateur important. La fabrication du chlore fournit simultanément de la soude et de l'hydrogène : chlore et soude constituent donc des coproduits dont, normalement, les demandes s'équilibrent ; cependant, il y a parfois déséquilibre ; c'est ainsi que des besoins accrus en soude nécessitent, depuis le début des années quatre-vingt-dix, l'obtention d'une certaine quantité de celle-ci par caustification du carbonate de sodium.
Propriétés
Le chlore, dont le tableau présente les principales propriétés physiques, se situe dans la septième colonne du tableau de Mendeleïev. Possédant sept électrons périphériques, il a tendance à en capter un huitième pour former l'anion chlorure Cl-, en passant au degré d'oxydation − 1 ; mais, avec ses trois doublets libres, il peut également former diverses liaisons atomiques dans lesquelles ce degré est compris entre + 1 et + 7.
Sa pression de vapeur à 20 0C étant de 6,5 bar (1 bar = 105Pa), le chlore est aisément liquéfiable, soit par refroidissement au-dessous de − 35 0C, soit par compression sous 7 à 10 bars, soit par refroidissement et compression.
Il est assez soluble dans l'eau (4,6 l/l à 0 0C ; 2,3 l/l à 20 0C) et peut donner un hydrate (voisin de Cl2 . 6H2O) vers 0 0C ; il est soluble dans le tétrachlorure de carbone CCl4. Élément très actif, il est, du fait de son caractère électronégatif, très avide d'hydrogène et se comporte souvent comme un oxydant. Il réagit avec la plupart des éléments non métalliques, sauf avec le carbone ; parfaitement sec, il est sans action sur les métaux, mais il suffit d'une trace d'eau pour qu'il les attaque tous, y compris l'or et le platine. Il est donc très corrosif.
Il déplace le brome et l'iode de leurs composés ; il en est de même de l'oxygène, mais les réactions sont alors généralement limitées.
Ainsi, la réaction de dismutation :
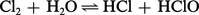
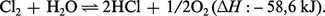
Cette réaction avec l'eau liquide explique les propriétés oxydantes de l'eau de chlore.
Avec les hydroxydes, le chlore donne lieu à des réactions de dismutation conduisant aux hypochlorites :
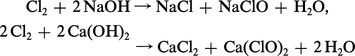
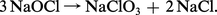
Il peut également fournir avec les composés organiques des réactions de déplacement[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri GUÉRIN : ingénieur de l'École supérieure de physique et chimie industrielles, professeur honoraire de l'université de Paris-XI
Classification
Pour citer cet article
Henri GUÉRIN. CHLORE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Médias
Autres références
-
ARMES - Armes lourdes
- Écrit par Alain BRU
- 3 925 mots
- 2 médias
...avril 1915, près d'Ypres, la première attaque chimique massive ; elle fit environ dix mille morts ou hommes hors de combat. Il s'agissait de vapeur de chlore. La suite du conflit connut une « course » parallèle aux produits plus toxiques, mais aussi aux équipements protecteurs. Les effets létaux furent... -
ATMOSPHÈRE - Chimie
- Écrit par Marcel NICOLET
- 3 553 mots
- 5 médias
-
BAÏKAL LAC
- Écrit par Laure ARJAKOVSKY et Pierre CARRIÈRE
- 4 073 mots
- 2 médias
...la quantité des sulfates était passée de 330 000 tonnes par an en 1962 à 470 000 tonnes par an en 1992 ; pour la même période, le taux des dérivés du chlore a augmenté de 49 000 à 69 000 tonnes par an, et les matières organiques sont passées de 500 000 à 790 000 tonnes par an. S'agissant de la pollution... -
BERTHOLLET CLAUDE LOUIS (1748-1822)
- Écrit par Michelle GOUPIL-SADOUN
- 1 193 mots
...édition en 1804, l'ouvrage de Berthollet resta longtemps le manuel des ouvriers en teinture. Il découvrit aussi le procédé du blanchiment des toiles par le chlore. La chimie industrielle lui doit enfin des études importantes sur la fabrication et la nature des aciers, qu'il réalisa en 1786 avec Vandermonde... - Afficher les 23 références








