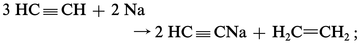ACÉTYLÈNE
Caractéristiques de l'acétylène
Propriétés physiques
L'acétylène (C2H2), de masse molaire 26,028, est un gaz incolore dont l'odeur rappelant le géranium est généralement masquée par celle, aliacée, de la phosphine (PH3) ; l'arsine (AsH3) qui peut accompagner la phosphine étant en revanche très fréquemment inodore.
Voici quelques caractéristiques : volume molaire : 22,12 l ; masse du litre à 0 0C : 1,17 g ; température d'ébullition : 35 0C ; point critique : 6,11 MPa ; sa température de fusion est F : – 81,8 0C ; il se sublime dès – 83 0C ; on peut le fondre sous pression : pression de vapeur de 2,6 MPa à 0 0C et de 3,8 MPa à 15 0C.
L'acétylène liquide est incolore, de densité 0,62, et constitue un explosif.
Ses limites d'inflammabilité sont dans l'air sec : 2-80 p. 100, dans l'air humide : 3-77 p. 100, dans l'oxygène : 3-93 p. 100.
Il est relativement soluble dans l'eau, avec laquelle il peut donner un hexahydrate : sa solubilité atteint 1,97 g/l sous une pression de 0,1 MPa à 0 0C ; à 10 0C : 1,21 ; à 20 0C : 1,55 ; à 70 0C : 0,76 ; sous 1 MPa à 10 0C : 14,2 ; à 20 0C : 11,4. Il est très soluble dans l'acétone (25 g/l à 10 0C sous 0,1 MPa et 300 g/l à 10 0C sous 1,2 MPa), dans l'ammoniaque liquide et dans de nombreux composés carbonés : méthanol, acétonylacétone, phosphate triéthylique, diméthylsulfoxyde, diméthylformamide, méthylpyrrolidone.
Structure
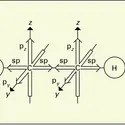
Les propriétés chimiques de l'acétylène s'expliquent essentiellement par la présence dans sa molécule d'une triple liaison constituée en fait par la superposition d'une liaison simple σ (provenant de la fusion de deux orbitales sp) à deux liaisons π résultant de la fusion de deux orbitales 2p. Cette liaison, de longueur 0,124 nm et caractérisée par une énergie de 811 kJ, est donc moins stable que les liaisons simples (614 kJ) et doubles (347,3 kJ), et par conséquent plus réactive.
D'autre part l'hydrogène lié au carbone par une triple liaison sera très mobile (ou acide), propriété que l'on retrouve dans les alcynes du type R − C ≡ C − H dits vrais pour les distinguer des autres du type R − C ≡ C − R′, qui ne possèdent pas d'hydrogène substituable par un métal.
Propriétés chimiques
L'acétylène dont la formation est endothermique (ΔH = 226,5 kJ/mole) est instable ; cela explique la facilité avec laquelle il donne lieu à des réactions de synthèse et sa grande chaleur de combustion (58 000 kJ/m3) :

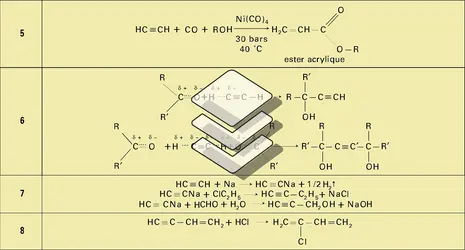
C'est la raison pour laquelle, au lieu de le vendre à l'état liquide ou de gaz comprimé, on le véhicule dissous dans l'acétone en présence d'un corps poreux, sous une pression inférieure à 2 MPa. W. Reppe a pourtant réussi à l'utiliser sous pression (2 MPa) en le diluant avec 40 p. 100 d'azote.
Les mélanges d'air et d'acétylène risquent de s'enflammer au contact d'une flamme, d'une étincelle ou lorsqu'on les porte au-dessus de 300 0C : la combustion totale exige un volume d'air important sinon il se forme du noir de fumée.
La combustion, dans un brûleur adéquat, fournit une flamme blanche très lumineuse (vingt fois plus intense que celle du gaz de ville) dont la température dépasse 3 000 0C avec l'oxygène, et 2 000 0C avec l'air.
La puissance spécifique d'une telle flamme (quantité de chaleur formée dans l'unité de temps et par unité de section de l'orifice de sortie du mélange acétylène + oxygène) : 19,6 kJ.cm−2 . s−1, dépasse celle de toutes les autres flammes, et explique l'intérêt du chalumeau oxyacétylénique pour le[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri GUÉRIN : ingénieur de l'École supérieure de physique et chimie industrielles, professeur honoraire de l'université de Paris-XI
Classification
Pour citer cet article
Henri GUÉRIN. ACÉTYLÈNE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALCYNES
- Écrit par Jacques METZGER
- 3 301 mots
- 5 médias
-
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 165 mots
- 6 médias
-
HYDROCARBURES
- Écrit par Pierre LASZLO
- 4 523 mots
- 4 médias
La molécule d'acétylène (ou éthyne) C2H2 s'obtient, d'une part en faisant réagir le carbure de calcium C2Ca et l'eau, d'autre part et majoritairement par le procédé B.A.S.F., inventé durant les décennies 1920 et 1930, à partir de gaz naturel et d'autres hydrocarbures issus du pétrole.... -
JUPITER, planète
- Écrit par André BOISCHOT, André BRAHIC, Universalis, Daniel GAUTIER, Guy ISRAËL, Pierre THOMAS
- 11 281 mots
- 60 médias
...10 p. 100 d' hélium. S'y ajoutent une petite quantité de méthane (CH4) – de l'ordre de 0,1 p. 100 – et des quantités encore plus faibles d'acétylène (C2H2) et d'éthane (C2H6) ; ces deux derniers gaz sont produits dans la haute atmosphère par le rayonnement ultraviolet solaire,... - Afficher les 10 références
Voir aussi
- CHLORURE DE VINYLE
- NÉOPRÈNES
- ÉTHYLÈNE
- CHIMIQUES INDUSTRIES
- CARBURE DE CALCIUM
- OXYACÉTYLÉNIQUE CHALUMEAU
- EXPLOSIVES SUBSTANCES
- TRIPLE LIAISON ou LIAISON ACÉTYLÉNIQUE
- ADDITION, chimie
- ÉTHYNYLATION
- CRAQUAGE ou CRACKING, chimie
- AUTOTHERMIQUE PROCÉDÉ
- ACÉTYLURES
- ARC PROCÉDÉ À L'
- ACRYLONITRILE
- TRICHLORÉTHYLÈNE
- PERCHLORÉTHYLÈNE
- VINYLATION
- WULFF PROCÉDÉ
- PURIFICATION, physico-chimie
- ENDOTHERMIQUE RÉACTION
- CHAUX (oxyde et hydroxyde de calcium)
- GAZEUX ÉTAT
- BASF (Badische Anilin und Soda Fabrik) PROCÉDÉ
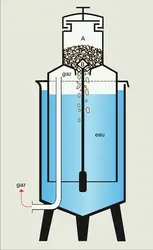
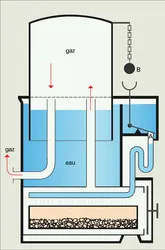
- GAZOMÈTRE
- BUTANEDIOL