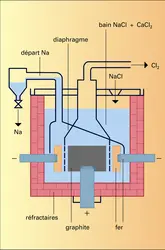
SODIUM
État naturel
Industrie des sels et de l'hydroxyde
Le sodium est contenu dans l'écorce terrestre à raison de 2,4 p. 100 en masse, proportion voisine de celle du potassium (2,1 p. 100). Il s'y trouve sous forme de roches feldspathiques très peu solubles, par exemple l'albite NaAlSi3O8, ou sous forme de sels solubles qui sont seuls exploités, et dont le chlorure est de loin le plus répandu.
L'existence de sels solubles en quantités bien plus importantes pour le sodium que pour le potassium est sans doute liée à la différence des énergies de solvatation des ions (393 kJ pour Na+, 343 kJ pour K+) qui provient de celle, déjà signalée, de leurs rayons ioniques.
Chlorure
Contenu dans l'eau de mer à raison de 32 g/l en moyenne, le chlorure de sodium (sel commun) constitue aussi d'importants gisements (sel gemme ou halite). Il a été exploité très tôt pour ses usages alimentaires : assaisonnement des aliments, conservation de la viande et du poisson. Il est devenu par ailleurs une matière première de base de l'industrie chimique.
Le sel marin obtenu par évaporation de l'eau de mer pour un tiers de sa production dans les marais salants et dans les mers anciennes (mer Morte et Grand Lac Salé). Le sel gemme (cf. roches salines) est purifié par fusion et il est dissous sur place par forage, la saumure étant remontée par pompage ; elle est utilisée telle quelle par l'industrie chimique ou concentrée dans des évaporateurs à multiples effets pour donner le sel ignigène.
La production mondiale, qui ne cesse de croître, était de 240 millions de tonnes en 2006, dont 48 Mt pour la Chine, 46 Mt pour les ÉtatsUnis et 7 Mt pour la France où 25 p. 100 environ de la production provenait des salines situées sur la Méditerranée. Dans ces deux derniers pays, plus de la moitié du sel est consommée par l'industrie chimique sous forme de saumures.
Cristallisé dans le système cubique, le chlorure de sodium fond à 801 0C et bout vers 1 413 0C. Sa solubilité dans l'eau varie peu avec la température : 360 grammes par litre d'eau à 20 0C, 398 g/l à 100 0C. L'hydrate à 2 H2O est en équilibre avec le sel anhydre et la solution saturée à + 0,15 0C (point de transition), et avec la glace et la solution à — 21 0C (point eutectique). La glace fond donc en présence de sel solide, avec abaissement de la température au voisinage de la température eutectique : de là l'utilisation du sel pour le déneigement des routes.
Comme le montre le tableau, le chlorure est la matière première d'un grand nombre de préparations fondées sur des traitements chimiques (sulfate, carbonate, etc.) ou bien électrochimiques (chlorate, hydroxyde, métal).
Carbonate
Quelquefois désigné par le terme de « soude », qu'il vaut mieux réserver à l'hydroxyde NaOH, le carbonate Na2CO3 est le sel le plus important avec le chlorure. Après avoir été longtemps extrait à l'eau des cendres de végétaux marins par lixiviation, il est aujourd'hui obtenu à partir du chlorure.
Préparation
Le premier procédé industriel de préparation, dû à Nicolas Leblanc, comprend les phases successives suivantes :
a) préparation du sulfate par action de l'acide sulfurique sur le chlorure :
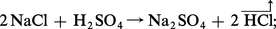
b) réduction du sulfate en sulfure par le carbone :
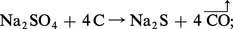
c) double décomposition entre le sulfure de sodium et le carbonate de calcium :
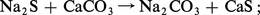
d) séparation du carbonate soluble.
La température nécessaire à la réaction (a) et aux réactions (b) et (c) réalisées simultanément est de 900 0C environ. Aussi, malgré diverses améliorations portant surtout sur la récupération du soufre contenu dans le sulfure, le procédé Leblanc a progressivement cédé la place au procédé à l'ammoniac, industrialisé par Ernest Solvay en 1865 et qui évite l'emploi de températures élevées. Il comporte les opérations suivantes[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Luc AUFFRET : ingénieur, directeur du marketing de Métaux spéciaux S.A.
- Albert HÉROLD : professeur à l'Institut, université de Paris-I
- André METROT : docteur ès sciences, maître assistant à l'Institut national polytechnique de Nancy
- Bernard PIRE : directeur de recherche émérite au CNRS, centre de physique théorique de l'École polytechnique, Palaiseau
Classification
Pour citer cet article
Luc AUFFRET, Albert HÉROLD, André METROT et Bernard PIRE. SODIUM [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
BOROPHÈNE
- Écrit par Bernard PIRE
- 990 mots
- 1 média
...propriétés, et sans doute à de nombreux développements technologiques. Une première application possible du borophène pourrait concerner les piles à base de sodium. En effet, le développement de ces piles – qui bénéficieraient par rapport à celles au lithium du caractère abondant et bon marché de l’élément... -
GLUTAMATE DE SODIUM
- Écrit par Geneviève DI COSTANZO
- 163 mots
Sel monosodique monohydraté de l'acide L(+) glutamique. Il augmente la saveur de nombreux aliments, les hydrolysats protéiques entre autres. Cette propriété, découverte en 1908 par le Japonais Ikeda Kikunae (1864-1936), le fait employer depuis lors comme arôme, en particulier dans des préparations...
-
MÉTAUX - Métaux alcalins
- Écrit par Jean PERROTEY
- 3 023 mots
- 4 médias
-
NUCLÉAIRE - Réacteurs nucléaires
- Écrit par Jean BUSSAC, Frank CARRÉ, Robert DAUTRAY, Jules HOROWITZ, Jean TEILLAC
- 12 438 mots
- 9 médias
...) et l' hélium sous pression. Parmi les liquides, l' eau ordinaire et l' eau lourde, qui sont aussi des modérateurs, ont la faveur des réacteurs à neutrons thermiques. Les réacteurs à neutrons rapides, qui excluent l'emploi de noyaux légers, ont utilisé des métaux fondus tels que le sodium. - Afficher les 11 références
Voir aussi
- SOUDE (hydroxyde de sodium)
- CARBONATE DE SODIUM
- SULFURES
- SELS
- SEL MARIN
- EAU, physico-chimie
- TEMPÉRATURE DE FUSION
- FUSION
- FLUIDE CALOPORTEUR
- SELS MINÉRAUX
- HYDRURES
- CARBURES
- CHIMIQUES INDUSTRIES
- ALCALINS
- CHLORURE DE SODIUM
- OXYDATION
- SULFATE DE SODIUM
- RÉDUCTEUR, chimie
- LEBLANC PROCÉDÉ
- HALITE
- ÉCLAIRAGE
- PHOSPHATES
- SEL GEMME
- BOUVEAULT & BLANC RÉACTION DE
- BLANCHETTIÈRE MÉTHODE DE
- CYANURE DE SODIUM
- CASTNER PROCÉDÉ
- DOWNS PROCÉDÉ
- PLOMB TÉTRAÉTHYLE
- SOLVAY PROCÉDÉ
- OXYDE DE SODIUM
- BOROHYDRURES
- HALOGÉNURES
- NITRATES
- ÉLECTROLYSE