SODIUM
Le sodium est le plus courant des éléments alcalins. Son nom dérive de l'arabe soda, qui désignait le mélange de carbonates alcalins extrait des cendres de végétaux. Le symbole Na vient de son appellation allemande Natrium, qui dérive de « natron », le carbonate de sodium naturel d'Égypte. Comme les autres alcalins, c'est un métal très réactif qui tend à perdre son électron périphérique : la plupart de ses composés le contiennent à l'état de cation Na+. Son numéro atomique (Z = 11) le place entre le lithium (Z = 3) et le potassium (Z = 19) dans la colonne Ia du tableau périodique. Mais ses propriétés et celles de ses composés le rapprochent davantage du second : les analogies du lithium avec les alcalino-terreux (combinaison directe avec l'azote, hydroxyde déshydratable en oxyde, carbonate et phosphate peu solubles) ne se retrouvent pas pour le sodium.
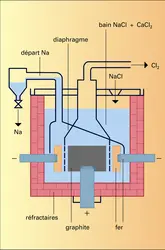
Les sels de sodium sont les plus employés des sels minéraux en raison de leur solubilité et de leur prix modéré. Quelques-uns existent dans la nature ; la plupart des autres, ainsi que l'hydroxyde, ou soude, qui est la principale base minérale, peuvent être préparés sans passer par le métal. Ce dernier, très réducteur, est difficile à obtenir par voie chimique : c'est par électrolyse de la soude fondue que Humphry Davy l'a isolé en 1807, et par électrolyse ignée du chlorure qu'il est préparé actuellement. Trop réactif pour être employé comme métal de structure, le sodium sert surtout de réducteur et d'intermédiaire dans la préparation de certains composés tant organiques que minéraux.
Propriétés physiques et chimiques
Propriétés physiques
Le sodium reflète dans ses propriétés physiques les traits caractéristiques de la famille des métaux alcalins. Il s'agit d'un métal mou, blanc et brillant lorsque sa surface n'est pas altérée. Il cristallise dans le système cubique centré, avec une maille de côté a = 0,428 20 nm à 20 0C.
Ses constantes physiques principales sont rassemblées dans le tableau.
Un étrange phénomène
Des physiciens du laboratoire de géophysique de l'institut Carnegie à Washington (États-Unis) ont découvert en 2005 un étrange phénomène concernant la température de fusion du sodium lorsque varie la pression à laquelle ce dernier est soumis. La fusion d'un solide apparaît lorsque l'agitation thermique des atomes prédomine sur les forces de liaisons interatomiques. Lorsqu'on soumet un solide à une pression, les effets de cette agitation sont en général amoindris et la température de fusion a donc tendance à croître. Une exception notable est l'eau pour laquelle la température de fusion diminue légèrement au-dessus d'une certaine valeur de la pression. Mais l'étude du sodium, qui est pourtant considéré comme un des métaux les plus simples puisqu'il n'a qu'un électron sur sa couche de valence, révèle un comportement encore plus étrange. À pression normale, le solide fond vers 371 K et cette température de fusion augmente d'abord avec la pression, jusqu'à 1 000 K environ sous 30 GPa (30 milliards de Pascal, soit environ 300 000 fois la pression atmosphérique normale). Elle diminue ensuite considérablement, atteignant 300 K (soit une température ambiante d'environ 27 0C fort supportable) vers 118 GPa. Ce liquide est alors plus dense que le solide usuel. De plus, des structures cristallines complexes apparaissent dans la phase solide à haute pression. Il se pourrait bien que le sodium, comme un certain nombre d'autres alcalins, ait à très haute pression des propriétés plastiques, mécaniques ou électriques surprenantes qu'il serait important de mettre à jour.
Propriétés chimiques
Action sur les[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Luc AUFFRET : ingénieur, directeur du marketing de Métaux spéciaux S.A.
- Albert HÉROLD : professeur à l'Institut, université de Paris-I
- André METROT : docteur ès sciences, maître assistant à l'Institut national polytechnique de Nancy
- Bernard PIRE : directeur de recherche émérite au CNRS, centre de physique théorique de l'École polytechnique, Palaiseau
Classification
Pour citer cet article
Luc AUFFRET, Albert HÉROLD, André METROT et Bernard PIRE. SODIUM [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
BOROPHÈNE
- Écrit par Bernard PIRE
- 990 mots
- 1 média
...propriétés, et sans doute à de nombreux développements technologiques. Une première application possible du borophène pourrait concerner les piles à base de sodium. En effet, le développement de ces piles – qui bénéficieraient par rapport à celles au lithium du caractère abondant et bon marché de l’élément... -
GLUTAMATE DE SODIUM
- Écrit par Geneviève DI COSTANZO
- 163 mots
Sel monosodique monohydraté de l'acide L(+) glutamique. Il augmente la saveur de nombreux aliments, les hydrolysats protéiques entre autres. Cette propriété, découverte en 1908 par le Japonais Ikeda Kikunae (1864-1936), le fait employer depuis lors comme arôme, en particulier dans des préparations...
-
MÉTAUX - Métaux alcalins
- Écrit par Jean PERROTEY
- 3 023 mots
- 4 médias
-
NUCLÉAIRE - Réacteurs nucléaires
- Écrit par Jean BUSSAC, Frank CARRÉ, Robert DAUTRAY, Jules HOROWITZ, Jean TEILLAC
- 12 438 mots
- 9 médias
...) et l' hélium sous pression. Parmi les liquides, l' eau ordinaire et l' eau lourde, qui sont aussi des modérateurs, ont la faveur des réacteurs à neutrons thermiques. Les réacteurs à neutrons rapides, qui excluent l'emploi de noyaux légers, ont utilisé des métaux fondus tels que le sodium. - Afficher les 11 références
Voir aussi
- SOUDE (hydroxyde de sodium)
- CARBONATE DE SODIUM
- SULFURES
- SELS
- SEL MARIN
- EAU, physico-chimie
- TEMPÉRATURE DE FUSION
- FUSION
- FLUIDE CALOPORTEUR
- SELS MINÉRAUX
- HYDRURES
- CARBURES
- CHIMIQUES INDUSTRIES
- ALCALINS
- CHLORURE DE SODIUM
- OXYDATION
- SULFATE DE SODIUM
- RÉDUCTEUR, chimie
- LEBLANC PROCÉDÉ
- HALITE
- ÉCLAIRAGE
- PHOSPHATES
- SEL GEMME
- BOUVEAULT & BLANC RÉACTION DE
- BLANCHETTIÈRE MÉTHODE DE
- CYANURE DE SODIUM
- CASTNER PROCÉDÉ
- DOWNS PROCÉDÉ
- PLOMB TÉTRAÉTHYLE
- SOLVAY PROCÉDÉ
- OXYDE DE SODIUM
- BOROHYDRURES
- HALOGÉNURES
- NITRATES
- ÉLECTROLYSE