- 1. Les isotopes naturels et artificiels de l’hydrogène
- 2. Le spectre de l’atome d’hydrogène et l’avènement de la mécanique quantique
- 3. Hydrogène et naissance de l’électrodynamique quantique
- 4. Structure du noyau de l’atome d’hydrogène et chromodynamique quantique
- 5. L’antihydrogène
- 6. Les phases de l’hydrogène
- 7. Hydrogène et astrophysique
- 8. Hydrogène et énergie
HYDROGÈNE (physique)
- Article mis en ligne le
- Modifié le
- Écrit par Bernard PIRE
Le spectre de l’atome d’hydrogène et l’avènement de la mécanique quantique
L’observation d’un arc-en-ciel introduit à la notion de spectre d’un rayonnement. La lumière du soleil, en traversant un nuage de gouttelettes d’eau, se décompose en rayons de couleurs différentes, du rouge au violet, c’est-à-dire en ondes électromagnétiques de diverses longueurs d’onde. Le spectre du soleil semble continu, mais des physiciens du xixe siècle – dont le plus connu est le Danois Anders Angström (1814-1874) – ont découvert que les éléments, et en particulier l’hydrogène, n’émettaient de la lumière qu’à certaines longueurs d’onde discrètes, bien définies : un élément est ainsi caractérisable par un ensemble (ou spectre) de raies d’émission.
Les longueurs d’onde des raies d’un spectre ne sont pas indépendantes les unes des autres. En 1885, le mathématicien suisse Johann Balmer (1825-1898) propose une formule empirique pour décrire les ondes présentes dans le spectre de l’hydrogène : leur longueur d’onde λ est égale à H·m2/(m2 – 4), avec H = 364,56 nanomètres (nm), m prenant les valeurs entières supérieures à 2. Trois ans plus tard, Johannes Rydberg (1854-1919) généralise cette formule en l’écrivant sous la forme 1/λ = RH(1/n2 – 1/m2), n et m étant des entiers, avec m > n, et RH, dénommée constante de Rydberg (1854-1919), ayant pour valeur 10 973 730 m-1.Cette formule permet de rendre compte non seulement des raies correspondant à la série de Balmer (dans laquelle n = 2) mais aussi des séries dites de Lyman (n = 1), de Paschen (n = 3), de Brackett (n = 4) et de Pfund (n = 5), qu’on détecte dans les domaines ultraviolet (série de Lyman, longueurs d’onde de 121 à 91 nm), visible (série de Balmer, longueurs d’onde de 636 à 365 nm) ou infrarouge (les autres séries, longueurs d’onde de 820 à 7 496 nm).
En 1896, le physicien néerlandais Pieter Zeeman (1865-1943) découvre que l’application d’un champ magnétique sur l’hydrogène a pour effet de scinder chaque raie du spectre en plusieurs lignes. Cet effet est appelé effet Zeeman. L’explication de ces séries de raies et de lignes nécessitera une meilleure compréhension de la structure de l’atome d’hydrogène et accompagnera de façon décisive l’avènement de la physique quantique moderne.
Après avoir découvert l’électron en 1897, Joseph J. Thomson (1856-1940) propose, en 1904, de décrire un atome – celui d’hydrogène puisque c’est le plus simple – comme un ensemble électriquement neutre, un « pudding » chargé positivement dans lequel est plongé un électron, ce qui entraîne la neutralité. Le physicien japonais Hantaro Nagaoka (1865-1950) développe en même temps un modèle « saturnien » dans lequel l’atome est composé d’un noyau massif et d’« anneaux » d’électrons, mais l’impossibilité de rendre compte de la stabilité de l’édifice le fait renoncer à cette interprétation en 1908. En 1909 cependant, la célèbre expérience de Hans Geiger (1882-1945) et Ernest Marsden (1889-1970) sous la direction d’Ernest Rutherford (1871-1937) à Manchester démontre l’existence des noyaux atomiques. Ils observent en effet que des rayons alpha du radium traversent en général une feuille d’or ultramince quasiment sans déviation, mais que quelques-uns d’entre eux rebondissent comme s’ils avaient heurté un obstacle de très grande densité, un noyau. Cette découverte amène Rutherford à reprendre le modèle de Nagaoka, mais en le modifiant légèrement ; le « modèle planétaire » qu’il publie en 1911 considère que l’électron négatif est en orbite autour d’un noyau de charge positive qui rassemble la quasi-totalité de la masse atomique. Cette représentation souffre cependant elle aussi d’un défaut majeur : la configuration proposée ne peut pas être stable, les [...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Bernard PIRE : directeur de recherche émérite au CNRS, centre de physique théorique de l'École polytechnique, Palaiseau
Classification
Pour citer cet article
Bernard PIRE. HYDROGÈNE (physique) [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 27/09/2022
Médias
Autres références
-
DÉCOUVERTE DE L'HYDROGÈNE PAR CAVENDISH
- Écrit par Bernard PIRE
- 728 mots
L’article envoyé en mai 1766 par l’honorable Henry Cavendish (1731-1810) à la Royal Society, dont il est membre, décrit de façon magistrale la découverte d’un gaz léger s’échappant de certaines réactions chimiques : l’hydrogène. Ces travaux, publiés dans la livraison datée du 1...
-
ACIDO-BASIQUE ÉQUILIBRE
- Écrit par Pierre KAMOUN
- 2 955 mots
- 1 média
L'apport alimentaire en ions hydrogène H+ est essentiellement représenté par les amino-acides introduits par les protéines (10 g de protéines libèrent 6 à 7 milliéquivalents d'ions H+). -
AMMONIAC
- Écrit par Henri GUÉRIN
- 5 033 mots
- 5 médias
L'action des sels d'ammonium sur les métaux dans l'ammoniac liquide est semblable à celle des acides en phase aqueuse : on obtient un sel du métal attaqué et un dégagement d'hydrogène :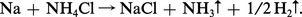
-
ARCHÉES ASGARD
- Écrit par Patrick FORTERRE
- 3 785 mots
- 3 médias
...avec une bactérie sulfato-réductrice du genre Desulfovibrio et une archée productrice du méthane du genre Methanogenium. L’archée Loki produit de l’hydrogène qui est utilisé par la bactérie pour produire du sulfure d’hydrogène et par Methanogenium pour produire du méthane. Hiroyuki Imachi... -
ASTROCHIMIE
- Écrit par David FOSSÉ et Maryvonne GERIN
- 4 388 mots
- 3 médias
- Afficher les 59 références








