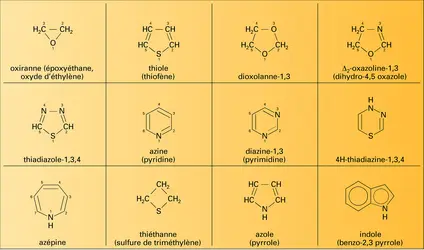
HÉTÉROCYCLES
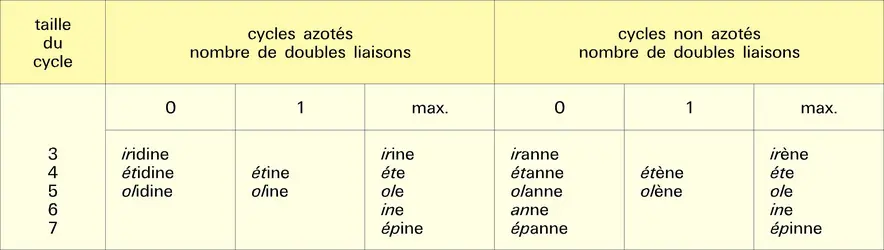
Hétérocycles à six chaînons
Hétérocycles monohétéroatomiques à six chaînons
Nomenclature et composés importants
Les cycles de base de cette série sont donnés dans la figure : pour l'hétéroatome azote, la pyridine, les dihydropyridines et, notamment, les pyridones, la pipéridine ; pour l'hétéro-atome oxygène ou soufre, les 2H-pyranne et thiopyranne et les 4H-pyranne et thiopyranne et, notamment, les pyrones, les Δ2 et Δ3 dihydropyranne et thiapyranne, et le tétrahydropyranne ou oxanne.
De très nombreux composés de ce groupe ont une importance pratique : on y rencontre par exemple des vitamines du complexe B (pyridoxine ou B6, nicotinamide ou PP), la vitamine E, de nombreux alcaloïdes (nicotine, papavérine), les sucres pyrannosiques (glycopyrannose), des colorants naturels (anthocyanidines).
Préparation
Les méthodes sont très nombreuses. Parmi celles qui partent d'une chaîne ouverte, citons la synthèse des pyridines et dihydropyridines selon Hantzsch (ester β-cétonique + aldéhyde + ammoniac), celle des quinoléines selon Skraup (addition de Michaël d'un dérivé carbonylé α, β-éthylénique sur une aniline, suivie d'une cyclisation acido-catalysée et d'une oxydation), celle des γ-pyrones (cyclisation de β-δ-tricétones), celles des thiapyrannes par cyclisation radicalaire de mercaptans ε-éthyléniques.
Propriétés chimiques
Composés à caractère aromatique
La pyridine présente une bonne réactivité de son atome d'azote vis-à-vis des réactifs électrophiles (réaction). Elle forme des sels avec les acides protoniques (pyridinium), des complexes de coordination avec les acides de Lewis et les cations des métaux de transition, des adduits avec les halogènes et l'anhydride sulfurique, et des sels quaternaires avec les halogénures d'alkyle réactifs. Les peracides la transforment en N-oxyde. Les atomes de carbone du cycle en β de l'azote sont assez difficilement attaqués par les réactifs électrophiles ; comme dans le cas des azoles, la protonation de l'azote en milieu acide, difficilement évitable, rend l'attaque encore plus lente. Cette orientation est conforme aux prévisions basées sur la théorie de la substitution électrophile en série benzénoïde.
Conformément aux prévisions de la même théorie, les réactifs nucléophiles attaquent de préférence en position-2 (réaction). L'attaque par les radicaux libres est moins sélective, elle se porte essentiellement sur les positions -2 et -4.
Les α- et γ-pyridones réagissent conformément aux prévisions de la théorie : les réactifs électrophiles attaquent soit l'atome d'oxygène carbonylique, soit l'atome de carbone en position-3, tandis que les réactifs nucléophiles attaquent soit en position-2, soit en position-4. Les N-oxydes présentent une réactivité particulière : les électrophiles les attaquent en position-4 et les nucléophiles forts en position-2 avec départ de l'oxygène (réactions).
Les sels de pyridinium, de pyrylium et de thiapyrylium sont très réactifs vis-à-vis des nucléophiles qui les attaquent en position-2 ou -4. Les groupes méthyle portés par ces cycles sont eux-mêmes très réactifs (condensation en cyanines). Les sels quaternaires de pyridinium, portant à l'azote un groupe fortement électron-attracteur, présentent l'intéressante propriété d'ouvrir leur cycle en milieu basique pour former la chaîne de l'aldéhyde glutaconique (réaction). Les groupes fonctionnels hydrogénés (− OH, − SH, − NH2) fixés en positions-2 et -4 sont susceptibles de protomérie (réaction).
Dérivés di-, tétra- et hexahydrogénés
Les dérivés dihydrogénés sont peu stables en série azotée : les dihydropyridines et quinoléines sont facilement oxydées en dérivés aromatiques. En série oxygénée et sulfurée l'aromatisation est également facile quoique les pyrannes (α ou γ) et les[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. HÉTÉROCYCLES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALCALOÏDES
- Écrit par Jacques E. POISSON
- 5 686 mots
- 5 médias
...catégorie définie de composés chimiques en raison de la variété de leurs structures moléculaires. Toutefois, d'une façon constante, ils possèdent un squelette hétérocyclique azoté, si l'on excepte quelques substances où l'azote est extracyclique (colchicine, éphédrine). La classification la plus accessible est... -
AROMATICITÉ
- Écrit par André JULG
- 4 706 mots
- 2 médias
De même, une molécule aromatique peut contenir des hétéroatomes. Par exemple, dans la pyridine C5H5N (formule 6), qui dérive formellement du benzène par le remplacement d'un groupement CH par un atome d'azote, c'est ce dernier qui fournit un électron au système conjugué. -
AZÉTIDINE ou TRIMÉTHYLÈNE-IMINE
- Écrit par Dina SURDIN
- 64 mots
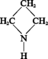
Masse moléculaire : 57,09 g
Masse spécifique : 0,843 g/cm3
Point d'ébullition : 63 0C.
Liquide incolore, fumant à l'air, d'odeur ammoniacale, soluble en toutes proportions dans l'eau et l'éthanol.
Le cycle à quatre chaînons s'ouvre facilement ; sous l'action de l'acide...
-
AZIRIDINE ou AZACYCLOPROPANE ou DIMÉTHYLÈNIMINE
- Écrit par Dina SURDIN
- 159 mots

Masse moléculaire : 43,07 g
Masse spécifique : 0,832 g/cm3
Point d'ébullition : 56 0C
Huile à très forte odeur ammoniacale, fumant à l'air. Miscible à l'eau, soluble dans l'éthanol.
Également appelée azacyclopropane, diméthylènimine ou bien cyclodiméthylène amine, l'aziridine...
- Afficher les 20 références
Voir aussi
- ÉLECTROPHILES RÉACTIONS
- BASE, chimie
- PYRIMIDINES
- CARBONÉE CHAÎNE
- DIELS-ADLER RÉACTION DE
- CYCLIQUES COMPOSÉS
- FRIEDEL & CRAFTS CATALYSEUR DE
- CYCLISATION
- FRIEDEL & CRAFTS RÉACTIONS DE
- NUCLÉOPHILES SUBSTITUTIONS
- INDOLE NOYAU
- PYRROLE & NOYAU PYRROLIQUE
- HÉTÉROATOME
- ÉPOXYDES
- DIAZINES
- THIOFÈNE ou THIOPHÈNE
- FISCHER BASE DE
- AZOLES
- CONJUGAISON, chimie
- NOMENCLATURE, chimie
- VITAMINE H
- RÉACTIVITÉ CHIMIQUE