HÉTÉROCYCLES
Hétérocycles à cinq chaînons
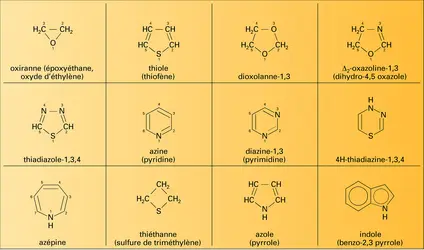
Hétérocycles monohétéroatomiques à cinq chaînons
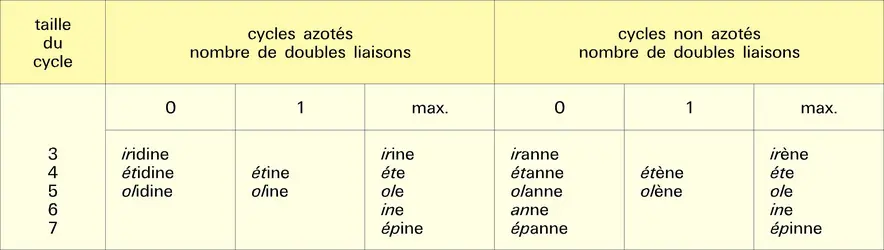
Nomenclature et composés importants
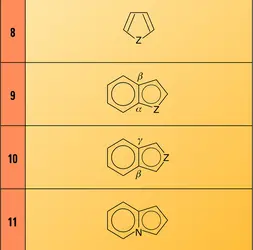
Les trois cycles de base des composés monocycliques aromatiques (formule) sont le pyrrole (Z = NH), le furanne (Z = O) et le thiofène (Z = S). Les radicaux qui en dérivent sont appelés respectivement pyrrolyle, furyle et thiényle. Le radical furyl-2-méthyle est appelé furfuryle.
Le cycle du pyrrole se rencontre dans de nombreux composés naturels ; ainsi les pigments biliaires, qui renferment quatre cycles pyrroliques en chaîne ouverte ; les pigments du sang comme l'hémine, constituant de l'hémoglobine, qui renferme quatre cycles pyrroliques en chaîne fermée dont les atomes d'azote sont les ligands d'un complexe du fer ; les chlorophylles, dont la structure tétrapyrrolique cyclique est stabilisée par complexation d'un atome de magnésium ; la vitamine B12. Le thiofène et ses homologues se rencontrent dans certains pétroles et dans la fraction benzénique des distillats de goudrons de houille.
Les composés monocycliques non aromatiques de base sont les pyrroles di- ou tétrahydrogénés, appelés respectivement pyrrolines et pyrrolidines, les di- et tétrahydrofurannes et di- et tétrahydrothiofènes. Deux amino-acides importants, la proline et l'hydroxyproline, sont des dérivés de la pyrrolidine. Le cycle du tétrahydrofuranne se rencontre dans de nombreux sucres (hexoses) comme par exemple le βD-fructofurannose encore appelé fructose. L'un des dérivés naturels les plus importants du tétrahydrothiofène est la vitamine H ou biotine, présente dans le jaune d'œuf.
Les dérivés de fusion en α, β d'un cycle benzénique sur les hétérocycles pentagonaux aromatiques (formule) portent des noms particuliers : l'indole (Z = NH), le benzofuranne ou coumarone (Z = O) et le thionaphtène (Z = S). Les isomères correspondant à la fusion en β, γ (formule) sont appelés iso-indole, isocoumarone et isothionaphtène. Parmi les dérivés bicycliques importants, on peut citer un amino-acide essentiel, le tryptophane ; une hormone végétale, l'acide indolyl-3-acétique (hétéro-auxine) ; l'indigo, une des premières matières colorantes naturelles employées dans l'industrie, et les nombreux alcaloïdes indoliques comme la yohimbine et la strychnine. Dans certains composés bicycliques, l'hétéroatome d'azote est lui-même engagé dans les deux cycles. C'est le cas en particulier de l'indolizine (formule).
Préparation
Deux méthodes principales sont utilisées pour la synthèse des hétérocycles de cette série :
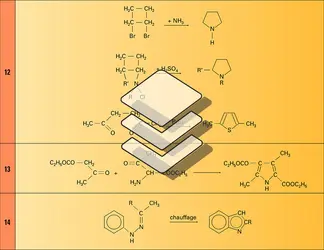
– les réactions avec formation d'une liaison entre l'hétéroatome et le squelette carboné ; les cycles à caractère aromatique peuvent être obtenus à partir des γ-dicétones. De nombreuses réactions particulières ont été développées pour la synthèse de ces hétérocycles (réactions) ;
– la réaction avec formation de la liaison C3 − C4 ; ici aussi de nombreuses voies ont été proposées, particulièrement en série pyrrolique. On citera seulement : la synthèse des pyrroles selon Knorr, condensation d'un ester β-cétonique avec une α-aminocétone (réaction) ; la synthèse des indoles selon Fischer, qui correspond à un réarrangement orthobenzidinique d'une phénylhydrazone (réaction) ; la synthèse de Hantzsch qui utilise une cétone α-halogénée dans une réaction avec une énamine, un ester β-cétonique ou une aniline pour donner respectivement un pyrrole, un furanne ou un indole (réaction).
Propriétés chimiques
Les réactions typiques de l'hétéroatome des amines, éthers et sulfures aliphatiques ne se retrouvent pas ici, ce qui s'explique aisément par la participation d'un doublet non partagé de l'hétéroatome à la conjugaison cyclique de la molécule avec, comme conséquence, la non-disponibilité de ce doublet pour[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. HÉTÉROCYCLES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALCALOÏDES
- Écrit par Jacques E. POISSON
- 5 686 mots
- 5 médias
...catégorie définie de composés chimiques en raison de la variété de leurs structures moléculaires. Toutefois, d'une façon constante, ils possèdent un squelette hétérocyclique azoté, si l'on excepte quelques substances où l'azote est extracyclique (colchicine, éphédrine). La classification la plus accessible est... -
AROMATICITÉ
- Écrit par André JULG
- 4 706 mots
- 2 médias
De même, une molécule aromatique peut contenir des hétéroatomes. Par exemple, dans la pyridine C5H5N (formule 6), qui dérive formellement du benzène par le remplacement d'un groupement CH par un atome d'azote, c'est ce dernier qui fournit un électron au système conjugué. -
AZÉTIDINE ou TRIMÉTHYLÈNE-IMINE
- Écrit par Dina SURDIN
- 64 mots
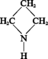
Masse moléculaire : 57,09 g
Masse spécifique : 0,843 g/cm3
Point d'ébullition : 63 0C.
Liquide incolore, fumant à l'air, d'odeur ammoniacale, soluble en toutes proportions dans l'eau et l'éthanol.
Le cycle à quatre chaînons s'ouvre facilement ; sous l'action de l'acide...
-
AZIRIDINE ou AZACYCLOPROPANE ou DIMÉTHYLÈNIMINE
- Écrit par Dina SURDIN
- 159 mots

Masse moléculaire : 43,07 g
Masse spécifique : 0,832 g/cm3
Point d'ébullition : 56 0C
Huile à très forte odeur ammoniacale, fumant à l'air. Miscible à l'eau, soluble dans l'éthanol.
Également appelée azacyclopropane, diméthylènimine ou bien cyclodiméthylène amine, l'aziridine...
- Afficher les 20 références
Voir aussi
- ÉLECTROPHILES RÉACTIONS
- BASE, chimie
- PYRIMIDINES
- CARBONÉE CHAÎNE
- DIELS-ADLER RÉACTION DE
- CYCLIQUES COMPOSÉS
- FRIEDEL & CRAFTS CATALYSEUR DE
- CYCLISATION
- FRIEDEL & CRAFTS RÉACTIONS DE
- NUCLÉOPHILES SUBSTITUTIONS
- INDOLE NOYAU
- PYRROLE & NOYAU PYRROLIQUE
- HÉTÉROATOME
- ÉPOXYDES
- DIAZINES
- THIOFÈNE ou THIOPHÈNE
- FISCHER BASE DE
- AZOLES
- CONJUGAISON, chimie
- NOMENCLATURE, chimie
- VITAMINE H
- RÉACTIVITÉ CHIMIQUE