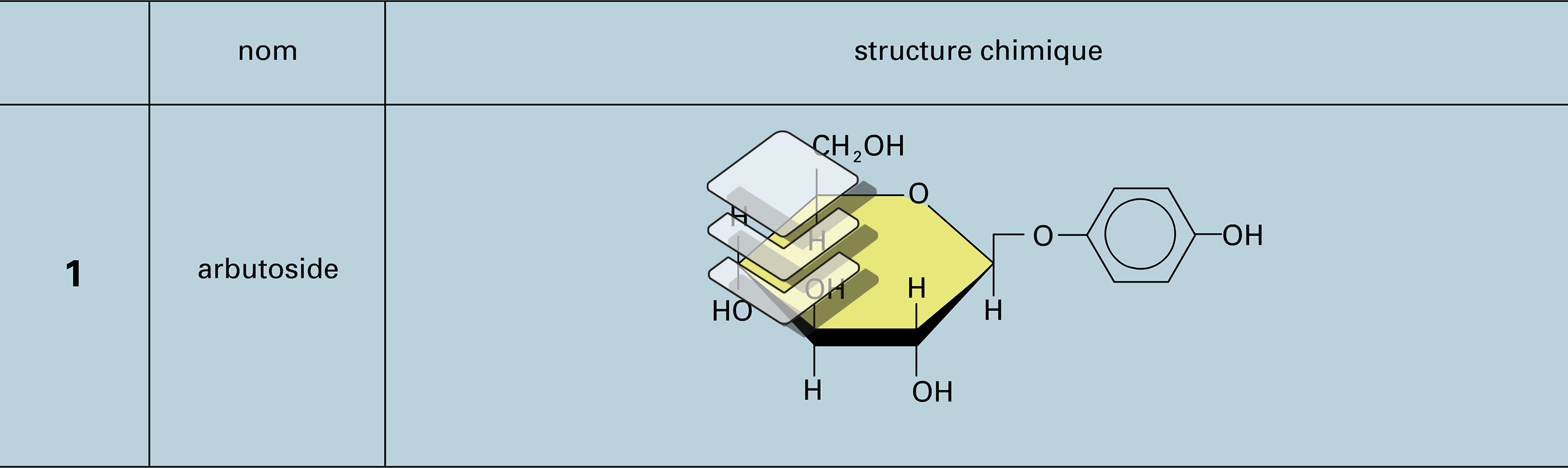
GLUCIDES
Les glucides, les lipides et les protides sont les trois grandes familles de composés naturels dont le rôle biologique est fondamental. Glucides est le nom moderne de ce que l'on appelait autrefois « saccharides ». En fait, les glucides comprennent, outre des matières naturelles sucrées, dont le type est la saccharose, un certain nombre d'analogues purement synthétiques et de nombreux dérivés, naturels pour la plupart. On les divise en trois classes : oses, holosides, hétérosides. Seuls les oses ne sont pas hydrolysables. L'hydrolyse des holosides fournit exclusivement des oses ou des mélanges d'oses, alors que celle des hétérosides donne, à côté d'un ou plusieurs oses, une ou plusieurs molécules d' aglycones qui ne sont plus des oses.
Bien que la structure des glucides soit souvent complexe, leur chimie ne fait intervenir que deux fonctions fondamentales : la fonction carbonyle (aldéhyde ou cétone) et la fonction alcool.
Les oses se divisent en « oses normaux » dont la formule « linéaire » est CH2OH−(CHOH)n-2−CHO pour les aldoses (n > 3) ou CH2OH− (CHOH)n-3−CO−CH2OH pour les cétoses (avec n > 4). Les « oses anormaux » sont également nombreux. Ils diffèrent des premiers par l'absence d'une ou de plusieurs fonctions alcool remplacées par des fonctions hydrocarbure (désoxyoses), la place différente du groupe cétonique dans le cas des cétoses, la ramification éventuelle de la chaîne qui fait apparaître deux fonctions alcool primaire et une fonction alcool tertiaire, l'oxydation plus profonde (osones), qui crée plusieurs fonctions carbonyles, l'impossibilité d'une cyclisation (oses trop pauvres en carbone).
Les oses normaux ont pour formule brute (CH2O)n ; les holosides qui en dérivent s'écrivent Cn(H2O)p(p<n). Cette remarque les avait fait désigner autrefois par « hydrates de carbone », nom impropre ; il exclut en effet les désoxyoses qui gardent un grand nombre des propriétés des oses normaux, et s'applique à des composés qui n'ont plus que de lointains rapports avec les oses.
Au sein du métabolisme des glucides, le D-glucose joue un rôle fondamental dans le fonctionnement des êtres vivants : c'est un générateur d'énergie facilement utilisable (dans un organisme animal, un gramme de glucides produit 17,1 kilojoules, cependant qu'un gramme de lipides, de densité plus faible, en fournit 37,6). Cette énergie, transitoirement conservée sous forme de substances « riches en énergie », dont le principal représentant est l'adénosine-triphosphate (ATP), peut être restituée par couplage de réactions d'hydrolyse de l'ATP en ADP (adénosine-diphosphate) ou AMP (adénosine-monophosphate) avec des réactions qui consomment de l'énergie. D'autre part, le métabolisme du glucose fournit un matériel de base pour la synthèse de substances indispensables à l'activité cellulaire : ribose (acides nucléiques), ribulose-1,5-diphosphate (assimilation chlorophyllienne), inositol (phospholipides), acide ascorbique (vitamine C de certains animaux), acides aminés (alanine, acides aspartique et glutamique), noyau benzénique (phénylalanine, tyrosine, tryptophane) et éventuellement acides gras (lipides) et stérols (membranes cellulaires, hormones...).
Oses
On peut les définir à partir des hexoses C6H12O6 dont le plus connu est le D-glucose.
Glucose
Le glucose constitue des efflorescences à la surface des fruits secs (raisin, figue). C'est le principal constituant du miel. Il se forme dans l' hydrolyse de nombreux holosides, polyosides, hétérosides.
L'industrie le prépare par hydrolyse acide de l'amidon. L'hydrolysat, neutralisé, est concentré sous vide ; on obtient le « glucose massé ». Celui-ci est purifié, après redissolution, passage au noir animal, et recristallisation. On obtient le glucose pur du commerce,[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean ASSELINEAU : professeur de biochimie à l'université de Toulouse-III
- Charles PRÉVOST : professeur à la faculté des sciences de Paris, à l'École centrale des arts et manufactures de Paris et à l'École normale supérieure de Fontenay-aux-Roses
- Fraidoun SHAFIZADEH : Manager, Pioneering Research Department, Weyerhaeuser Cy, Seattle, États-Unis
- Melville Lawrence WOLFROM
:
regent's professor of chemistry , Ohio State University, États-Unis
Classification
Pour citer cet article
Jean ASSELINEAU, Charles PRÉVOST, Fraidoun SHAFIZADEH et Melville Lawrence WOLFROM. GLUCIDES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Médias
Autres références
-
ÉTUDE DES SUCRES ET DES PEPTIDES
- Écrit par Arnaud HAUDRECHY
- 208 mots
- 1 média
Élève d'Adolf von Baeyer, l'Allemand Emil Hermann Fischer (1852-1919) soutient à Strasbourg une thèse en partie consacrée à l'étude d'hydrazines, ce qui l'amène à étudier ultérieurement les sucres (glucides), à Würzburg, en 1888. Après avoir montré la structure aldéhydique du glucose,...
-
ALIMENTATION (Aliments) - Classification et typologie
- Écrit par Ambroise MARTIN
- 4 590 mots
- 1 média
Lacaractéristique nutritionnelle commune à tous ces aliments est la présence de glucides (sucres) complexes, du point de vue de leur structure chimique, et facilement digestibles, regroupés sous le terme d'amidon, organisés en granules compacts au sein des cellules végétales. La digestion... -
ALIMENTATION (Comportement et pratiques alimentaires) - Évolution de la consommation
- Écrit par Pierre COMBRIS
- 4 325 mots
- 2 médias
...montrent que la croissance du revenu s'accompagne d'une très forte augmentation de la part des lipides (seuls les lipides d'origine végétale régressent), d'une baisse de la part des glucides (l'accroissement de la consommation des produits sucrés ne compensant pas la baisse de la consommation des céréales)... -
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Encyclopædia Universalis et Pierre KAMOUN
- 3 486 mots
- 6 médias
Lescopules carbonées des aminoacides gluco-formateurs rejoignent le métabolisme glucidique et peuvent conduire au glucose puis au glycogène : cette formation de glycogène à partir des aminoacides entre dans le cadre de la néoglucogenèse qui est sous la dépendance des hormones gluco-corticostéroïdes.... -
ANTIGÈNES
- Écrit par Joseph ALOUF
- 7 382 mots
- 5 médias
Les polyosides (polysaccharides dans la terminologie anglo-saxonne) sont des polymères à structure ordonnée, constitués par des motifs monomériques et donc des épitopes identiques se répétant à des intervalles réguliers le long de la macromolécule. Les motifs constitutifs y sont des oses ou des osides... - Afficher les 37 références