BENZÉNOÏDES
Propriétés chimiques
Le système électronique des composés benzénoïdes est caractérisé par la présence, autour d'un squelette formé de liaisons σ, d'un système d'électrons π, moins solidement liés énergétiquement : c'est ce système π qui interviendra dans les réactions chimiques. Les réactifs susceptibles d'attaquer ces composés sont donc essentiellement électrophiles (avides d'électrons). Ce sont soit des cations (chargés positivement), soit des molécules polaires présentant un centre électroniquement désaturé, soit des molécules polarisables (susceptibles de présenter, à l'approche du substrat aromatique, un centre électroniquement désaturé). Les radicaux libres sont également susceptibles de se combiner au système π de ces substrats.
L' orientation de la substitution électrophile sur le substrat aromatique sera déterminée à la fois par la charge des différents sommets et par la facilité avec laquelle un doublet π peut être mis à la disposition du réactif au niveau de chacun d'eux. Le premier critère n'intervient pratiquement que dans le cas des dérivés fonctionnels des hydrocarbures benzénoïdes, dont la répartition électronique n'est pas uniforme (perturbations dues aux hétéroatomes), il n'a que peu d'importance pour les hydrocarbures euxmêmes, dont la charge est sensiblement unitaire au niveau de tous les sommets. Le second critère exprime la différence de polarisabilité du système électronique π au niveau des différents atomes de carbone du squelette : il est seul à intervenir dans le cas de la substitution radicalaire (radicaux libres électriquement neutres).
Mécanisme général de la substitution électrophile sur les substrats aromatiques
L' étude cinétique de cette réaction a permis d'établir un schéma général pour décrire son mécanisme. Supposons que le réactif électrophile soit un cation E+ qui attaque une molécule de toluène. Ce cation s'approche du substrat selon une direction perpendiculaire au plan du cycle ; c'est en effet dans cette direction que la densité du système π est la plus grande et que sa polarisabilité est la plus importante. Il se forme, dans un premier temps, un complexe peu solide entre le substrat et le réactif E+, appelé complexe π (, b). Ce complexe π se réorganise en localisant le réactif E au niveau de l'atome de carbone du substrat vers lequel le transfert d'un doublet π est énergétiquement le plus favorable (sommet le plus polarisé ou le plus polarisable), et forme un nouveau complexe, appelé complexe σ (, c), dans lequel l'atome de carbone, centre de réaction, est lié par une liaison σ au réactif E. Le système π de ce complexe, ne comportant plus que deux doublets, répartis sur les cinq atomes de carbone restants, a perdu son caractère de conjugaison cyclique et l'importante stabilisation qui lui est attachée : la durée de vie du complexe σ peut être extrêmement courte (de l'ordre d'une période de vibration de liaison), c'est alors un état de transition, ou bien elle peut être suffisante pour lui donner une existence transitoire, et c'est alors un complexe intermédiaire.
Dans les deux cas, le complexe σ se transforme spontanément en éliminant un proton H+ pour restaurer le système conjugué cyclique d'électrons π, en formant le produit final de la réaction (, e). L'élimination du proton peut se faire par l'intermédiaire d'un nouveau complexe π (, d). Dans certains cas (réactions réversibles), le complexe σ peut éliminer le cation E+ et on retrouve alors le substrat de départ. Généralement, le proton est éliminé par l'anion qui accompagne le réactif cationique E+. Un mécanisme semblable faisant intervenir un complexe σ a été proposé pour décrire la réaction de substitution des composés benzénoïdes par les radicaux[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. BENZÉNOÏDES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Médias
Autres références
-
ANTHRACÈNE
- Écrit par Dina SURDIN
- 233 mots
Formule brute : C14H10
Masse moléculaire : 178,22 g
Masse spécifique : 1,25 g/cm3
Point de fusion : 217 0C
Point d'ébullition : 354-355 0C.
Cet hydrocarbure cyclique cristallise en prismes monocliniques incolores et présente une fluorescence violette quand il est absolument pur.
L'énergie...
-
AROMATICITÉ
- Écrit par André JULG
- 4 706 mots
- 2 médias
Considérons d'abord les hydrocarbures. Deux cas se présentent :ou bien la molécule ne contient que des cycles pairs (hydrocarbures benzénoïdes), ou bien elle possède au moins un cycle impair (fulvène, azulène et molécules dérivées : benzofulvène, benzoazulène...). Dans les premières molécules,... -
ASTROCHIMIE
- Écrit par David FOSSÉ et Maryvonne GERIN
- 4 388 mots
- 3 médias
...de carbone, et l'on pense qu'ensemble elles recèlent de 10 à 20 p. 100 du carbone cosmique. Pourtant, aucune n'a jamais été spécifiquement identifiée. C'est pour expliquer la présence de bandes caractéristiques dans le spectre infrarouge de nombreuses nébuleuses que les astronomes ont en effet imaginé... -
BENZÈNE
- Écrit par Dina SURDIN
- 477 mots
Le plus simple des hydrocarbures aromatiques.
Formule : C6H6
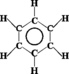
Fréquemment symbolisé par :
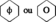
Masse moléculaire : 78,11 g
Masse spécifique : 0,88 g/cm3
Point de fusion : 5,5 0C
Point d'ébullition : 80,09 0C.
Cristaux incolores dans le système orthorhombique bipyramidal. Forme un azéotrope...
- Afficher les 11 références








