PHOSPHORE
Oxoacides, oxoanions et oxosels
La chimie des oxoacides du phosphore est extrêmement complexe et, de ce fait, il y eut pendant longtemps beaucoup de confusion parmi l'ensemble des composés que l'on arrivait à préparer. Actuellement, les déterminations structurales sont mieux connues. On peut diviser les oxoacides du phosphore en deux grandes classes : les oxoacides inférieurs et les oxoacides correspondant à l'acide orthophosphorique et aux acides phosphoriques condensés.
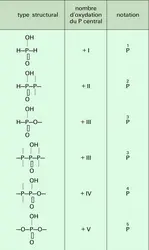
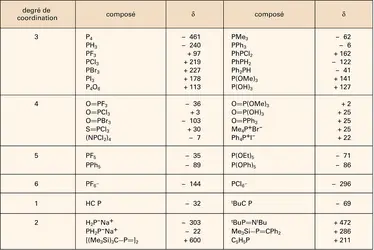
Dans tous ces acides, la présentation du nombre d'oxydation attribué au phosphore est primordiale pour un classement convenable et les notations de Blaser et Worms sont très précieuses. Ces notations sont fondées sur les liaisons entre le phosphore et les atomes qui composent les squelettes d'une combinaison donnée. Dans tous les oxoacides, l'atome de phosphore est lié à un ou plusieurs groupes OH ionisables. De plus, pratiquement dans tous les cas, on rencontrera pour l'atome de phosphore la configuration la plus stable correspondant à l' hybridation sp3. On aura donc quatre atomes directement liés au phosphore suivant un arrangement de type tétraédrique plus ou moins déformé.
Il y a alors six combinaisons possibles qui conduisent à six structures types dont les atomes de phosphore centraux ont par convention les nombres d'oxydation donnés dans le tableau 6. On peut ainsi s'attendre à un assez grand nombre d'oxoacides inférieurs mettant en jeu des phosphores PI à PV ainsi qu'à plusieurs types d'acides phosphoriques où l'on ne rencontrera que le phosphore PV.
Oxoacides inférieurs
Assez nombreux, de structure linéaire ou cyclique, les oxoacides inférieurs ne sont pas toujours isolés en tant qu'acides, mais au moins connus en tant que sels. On ne donnera ici des indications que sur quelques-uns d'entre eux.
L'acide hypophosphoreux H3PO2 (acide en PI) peut être préparé à partir d'une solution d'hydroxyde de baryum traitée à l'ébullition avec du phosphore blanc. Il se forme également le sel de baryum de l'acide orthophosphoreux H3PO3 (acide en PIII), qui est insoluble. La préparation peut être réalisée en faisant passer de l'hydrogène phosphoré dans une suspension aqueuse d'iode :
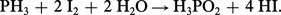
L'acide hypophosphoreux pur cristallise sous forme de feuillets incolores (température de fusion 26,5 0C). C'est un monoacide, pK = 1,1. Il se décompose sous l'action de la chaleur en acide orthophosphorique et phosphine. L'acide hypophosphoreux et ses sels sont de forts agents réducteurs.
Les études structurales de l'anion hypophosphite dans les sels d'ammonium et de calcium ont démontré qu'il s'agissait d'un arrangement tétraédrique : P—O, 0,151 nm ; O—P—O, 1200 ; H—P—H, 920.
L'acide orthophosphoreux H3PO3 (acide en PIII) peut être préparé en traitant son anhydride P4O6 par de l'eau. La préparation la plus utilisée parce que la plus commode consiste à hydrolyser le trichlorure de phosphore :
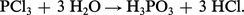
L'acide H3PO3 peut être purifié par cristallisation. Il fond à 70,1 0C, donnant un liquide clair légèrement visqueux. Il est facilement soluble dans l'eau et se comporte comme un diacide, pK1 = 1,3 et pK2 = 6,7. Les deux types de sels (neutres et acides) sont connus.
L'acide H3PO3 et ses sels sont décomposés par la chaleur pour donner, en l'absence d'eau, de l'acide orthophosphorique et de la phosphine :
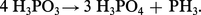
Le sel monosodique de l'acide 3P chauffé à 110 0C se convertit en sel disodique de l'acide H3PO3—O— H3PO3, acide diphosphoreux ou pyrophosphoreux H4P2O5.
L'acide orthophosphoreux et ses sels sont des réducteurs moins énergiques cependant que l'acide hypophosphoreux. L'acide orthophosphoreux a une structure tétraédrique distordue P—H, 0,139 nm ; P—OH, 0,154 nm ; P=O, 0,147 nm. Les mono-, diesters[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- François MATHEY : professeur à l'École polytechnique, directeur de recherche au C.N.R.S.
- Maurice MAURIN : professeur à l'université des sciences humaines de Nanterre
- Maurice SLANSKY : docteur ès sciences, ingénieur géologue, École nationale des sciences géographiques, conseiller scientifique au Bureau de recherches géologiques et minières
Classification
Pour citer cet article
François MATHEY, Maurice MAURIN et Maurice SLANSKY. PHOSPHORE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
AGRICULTURE - Agriculture et industrialisation
- Écrit par François PAPY
- 7 421 mots
- 3 médias
-
CUIVRE
- Écrit par C.I.C.L.A., Jean-Louis VIGNES
- 8 229 mots
- 4 médias
Les principaux éléments d'addition sont le phosphore, le zinc et le plomb. -
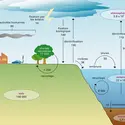
CYCLES BIOGÉOCHIMIQUES
- Écrit par Jean-Claude DUPLESSY
- 7 878 mots
- 6 médias
Le phosphore (P) est un élément essentiel de la matière vivante, suffisamment rare pour constituer un élément limitant pour de nombreux écosystèmes. -
EAU - Approvisionnement et traitement
- Écrit par Georges BREBION, Cyrille GOMELLA, Bernard LEGUBE
- 10 057 mots
- 5 médias
Comme l'azote, le phosphore n'est que partiellement éliminé par les procédés biologiques conventionnels (rendements < 20 p. 100). L'élimination plus poussée du phosphore peut être assurée soit par voie physico-chimique (précipitation par un sel de fer), soit par voie biologique spécifique. La déphosphatation physico-chimique est efficace, facile à mettre en œuvre, mais présente l'inconvénient d'augmenter la production de boues. La déphosphatation biologique est obtenue en favorisant le développement de bactéries qui ont la propriété d'accumuler par stockage intracellulaire de grandes quantités de phosphore (jusqu'à 10 p. 100 de leur poids sec contre 1,5 à 2 p. 100 pour les micro-organismes classiques). La condition essentielle pour le développement des bactéries déphosphatantes est le passage des boues activées dans une zone anaérobie puis dans une zone aérobie. - Afficher les 19 références
Voir aussi
- SULFURES
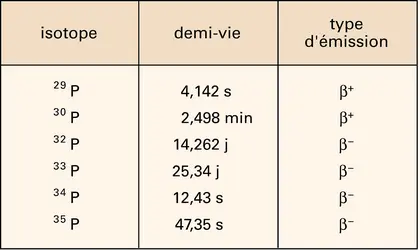
- ISOTOPES
- GUANO
- MINÉRALE CHIMIE
- OXYDORÉDUCTION
- COURANTS MARINS
- PHOSPHINES
- CYCLIQUES COMPOSÉS
- HYDRURES
- CONDENSATION, chimie
- THIOHALOGÉNURES
- ORTHOPHOSPHOREUX ACIDE
- ORTHOPHOSPHORIQUE ACIDE
- PHOSPHOREUX ACIDE
- PHOSPHORIQUES ACIDES
- PHOSPHINE (phosphure d'hydrogène)
- ANHYDRIDE PHOSPHORIQUE
- ANHYDRIDE PHOSPHOREUX
- OXYHALOGÉNURES
- PHOSPHONITRILE
- THIOPHOSPHATES
- PEROXOPHOSPHATES
- PYROPHOSPHORIQUE ACIDE
- ULTRAPHOSPHATES
- ORGANOPHOSPHORÉS COMPOSÉS
- HYPOPHOSPHOREUX ACIDE
- FLUOROPHOSPHATES
- MÉTAPHOSPHORIQUES ACIDES
- HÉTÉROPOLYACIDES
- HYBRIDATION DES ORBITALES
- HALOGÉNURE DE PHOSPHORE
- OXACIDES ou OXOACIDES
- PHOSPHATES SÉDIMENTAIRES
- RÉDUCTEUR, chimie
- PHOSPHATES
- PHOSPHURES
- OXYCHLORURES
- POLYPHOSPHATES
- PROSPECTION
- TÉTRAÈDRE, stéréochimie
- GISEMENT, géologie
- CONFIGURATION ÉLECTRONIQUE
- ALLOTROPIE
- OXYDES
- YLURES DE PHOSPHORE
- HALOGÉNURES
- CHLORURES
- RÉACTIVITÉ CHIMIQUE
- PHOSPHORE 31