PHOSPHORE
Composés du phosphore
Élément du groupe 15 appartenant à la seconde longue rangée du tableau périodique (3e période), le phosphore a une configuration électronique semblable à celle de l'azote. Des analogies dans la chimie de ces deux éléments sont dès lors prévisibles. La couche de valence possédant cinq électrons, on peut s'attendre à l'existence de composés dont les états d'oxydation pour l'élément considéré varieront de — III à + V.
La figure 1 présente le diagramme d' oxydoréduction du phosphore pour quelques composés hydrogénés ou oxygénés en solution à pH = 0. Les potentiels normaux d'oxydoréduction sont donnés par les pentes des segments correspondant aux couples envisagés. Sur ce diagramme, la molécule de phosphore paraît être instable vis-à-vis des états + I et — III.
On peut s'attendre à une dismutation facile suivant la réaction :
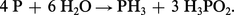
L'acide hypophosphoreux H3PO2 est lui-même instable. Ce diagramme indique également que même des oxydants faibles conduisent à l'oxydation des composés du phosphore jusqu'à l'état d'oxydation + V, c'est-à-dire l'acide phosphorique.
Dans tous ces composés, étant donné l'énergie d'ionisation élevée et la grande valeur de l'électronégativité, les liaisons seront à caractère presque exclusivement covalent.
Cependant, il existe des différences notables entre les deux éléments azote et phosphore. Ainsi, la tendance de ce dernier à former avec l'oxygène, l'azote ou le carbone des composés non saturés et stables, ayant des liaisons de type pπ-pπ analogues aux dérivés nitrés, nitrosés et aux imines est sensiblement réduite.
Cette différence se manifeste déjà dans l'état moléculaire : molécule linéaire d'azote N ≡ N triplement liée, molécule tétraédrique de phosphore P4, constituée d'un atome de P lié à trois autres par trois liaisons simples.
Le phosphore se distingue encore de l'azote par la possibilité d'utiliser ses orbitales 3d, ce qui conduit à la mise en jeu de liaisons de type pπ-dπ et, par ailleurs, à un plus grand nombre d'hybridations des orbitales, cela expliquant les composés à cinq et six liaisons autour d'un atome de phosphore, composés inconnus pour l'azote (fig. 2 et tabl. 4).
Cependant, les électrons d ont une énergie élevée ; il faut environ 836 kJ/mole pour promouvoir un électron 3p du phosphore dans une orbitale 3d. Aussi, bien que l'hybridation des orbitales conduise à un abaissement de l'énergie du composé chimique correspondant, les arrangements mettant en jeu les orbitales d seront moins stables que ceux correspondant aux orbitales p et s. Cela signifie qu'il y aura seulement un nombre restreint de combinaisons dans lesquelles les orbitales d jouent un rôle majeur.
Combinaisons binaires
Les combinaisons binaires du phosphore sont très nombreuses puisqu'en dehors des gaz rares et des derniers éléments de la classification périodique (beaucoup de ceux-ci n'ayant pas encore fait l'objet d'une étude approfondie) on connaît une ou plusieurs combinaisons binaires pour chacun des autres éléments.
Phosphures métalliques
La méthode la plus simple et la plus générale pour préparer les phosphures métalliques consiste à chauffer le métal avec du phosphore rouge ou de la vapeur de phosphore en atmosphère non oxydante.
Les phosphures alcalins ou alcalino-terreux (Na3P, Ca3P2, Sr3P2) ont un caractère ionique non négligeable ; comme ceux d'autres métaux très électropositifs, ils sont généralement rapidement hydrolysés par l'eau avec formation de phosphine PH3. Il faut aussi signaler la découverte de NaP5 et KP5 qui contiennent l'ion cyclique à cinq chaînons [P5]—. Cet ion est isoélectronique de l'ion cyclopentadiénure [C5H5]— et, comme lui,[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- François MATHEY : professeur à l'École polytechnique, directeur de recherche au C.N.R.S.
- Maurice MAURIN : professeur à l'université des sciences humaines de Nanterre
- Maurice SLANSKY : docteur ès sciences, ingénieur géologue, École nationale des sciences géographiques, conseiller scientifique au Bureau de recherches géologiques et minières
Classification
Pour citer cet article
François MATHEY, Maurice MAURIN et Maurice SLANSKY. PHOSPHORE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 25/03/2009
Médias
Autres références
-
AGRICULTURE - Agriculture et industrialisation
- Écrit par François PAPY
- 7 421 mots
- 3 médias
-
CUIVRE
- Écrit par C.I.C.L.A. et Jean-Louis VIGNES
- 8 229 mots
- 4 médias
Les principaux éléments d'addition sont le phosphore, le zinc et le plomb. -
CYCLES BIOGÉOCHIMIQUES
- Écrit par Jean-Claude DUPLESSY
- 7 878 mots
- 6 médias
Le phosphore (P) est un élément essentiel de la matière vivante, suffisamment rare pour constituer un élément limitant pour de nombreux écosystèmes. -
EAU - Approvisionnement et traitement
- Écrit par Georges BREBION , Cyrille GOMELLA et Bernard LEGUBE
- 10 057 mots
- 5 médias
Comme l'azote, le phosphore n'est que partiellement éliminé par les procédés biologiques conventionnels (rendements < 20 p. 100). L'élimination plus poussée du phosphore peut être assurée soit par voie physico-chimique (précipitation par un sel de fer), soit par voie biologique spécifique. La déphosphatation physico-chimique est efficace, facile à mettre en œuvre, mais présente l'inconvénient d'augmenter la production de boues. La déphosphatation biologique est obtenue en favorisant le développement de bactéries qui ont la propriété d'accumuler par stockage intracellulaire de grandes quantités de phosphore (jusqu'à 10 p. 100 de leur poids sec contre 1,5 à 2 p. 100 pour les micro-organismes classiques). La condition essentielle pour le développement des bactéries déphosphatantes est le passage des boues activées dans une zone anaérobie puis dans une zone aérobie. - Afficher les 19 références










