IODE
L' iode (du grec iôdês, « violet ») est l'élément chimique de numéro atomique 53, symbolisé par la lettre I. C'est, après l'astate, le moins réactif et le moins électronégatif des éléments halogènes. Présent en quantité notable dans certaines algues, l'iode joue chez les mammifères un rôle biologique important à travers deux hormones thyroïdiennes. Certains de ses isotopes radioactifs servent en imagerie nucléaire médicale, mais les isotopes radioactifs, dont 129I répandu dans l'atmosphère par les explosions et accidents nucléaires, provoquent des cancers de la thyroïde.
Propriétés physiques
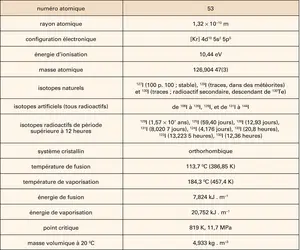
À l'état élémentaire, l'iode – dont les principales propriétés physiques sont indiquées dans le tableau – forme un solide moléculaire dans le réseau duquel se trouvent des molécules diatomiques I2. Solide à température et pression ambiantes, cristallisé (dans le système orthorhombique) en paillettes d'aspect métallique et de coloration gris sombre-noir, il se sublime à l'air en des vapeurs violettes. Peu soluble dans l'eau, dont il faut plusieurs litres pour en dissoudre un gramme, il se dissout dans l'alcool (teinture d'iode) et dans les solvants organiques (chloroforme, tétrachlorure de carbone, éther, disulfure de carbone), ainsi que dans les solutions aqueuses d'iodure de sodium et de potassium. Les solutions aqueuses et dans l'éthanol sont brunes. Celles qui sont effectuées dans le chloroforme, le tétrachlorure de carbone ou le disulfure de carbone sont violettes.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre LASZLO : professeur honoraire à l'École polytechnique et à l'université de Liège (Belgique)
Classification
Pour citer cet article
Pierre LASZLO. IODE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALIMENTATION (Économie et politique alimentaires) - Malnutrition dans le monde
- Écrit par Laurence ROUDART
- 7 611 mots
- 9 médias
La carence en iode est également très répandue. À partir de certains seuils et selon les sujets, cette insuffisance cause la formation d'un goitre thyroïdien, une arriération mentale et des cas de surdité-mutité chez les nouveau-nés. -
ANTISEPSIE ET ASEPSIE
- Écrit par Gabriel GACHELIN
- 587 mots
- 1 média
Classiquement, l’histoire de la chirurgie est scandée par deux dates : l’année 1846, au cours de laquelle l’anesthésie à l’éther est utilisée pour la première fois ; l’année 1867, au cours de laquelle le chirurgien britannique Joseph Lister (1827-1912) décrit le succès d’une...
-
CATALYSE
- Écrit par Henri Jean-Marie DOU, Jean-Eugène GERMAIN
- 8 394 mots
- 7 médias
Ainsi, vers 600 0C, la vapeur d'iode s'empare de l'hydrogène des alcanes pour former de l'acide iodhydrique et des alcènes ou des hydrocarbures dérivés du benzène, de rapport H/C plus faible. D'autre part, l'oxygène attaque l'acide iodhydrique en lui arrachant son hydrogène, pour... -
HALOGÈNES
- Écrit par Jacques METZGER, Robert de PAPE
- 6 600 mots
- 5 médias
Les dérivés halogénés résultent du remplacement, par des halogènes F, Cl, Br, I, d'un ou de plusieurs atomes d'hydrogène des hydrocarbures. Ils se rencontrent rarement à l'état naturel : présence d'iode dans la tyroxine, présence de chlore dans l'antibiotique chloromycétine.... - Afficher les 12 références
Voir aussi
- THYROÏDIENNES HORMONES
- ISOTOPES
- RADIOÉLÉMENTS ou RADIONUCLÉIDES ou ISOTOPES RADIOACTIFS
- RADIOTHÉRAPIE
- ESSAIS NUCLÉAIRES
- TRACEURS RADIOACTIFS ou RADIOTRACEURS
- EAU DE MER
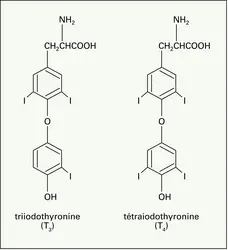
- TRIIODOTHYRONINE (T3)
- GOITRES
- COURTOIS BERNARD (1777-1838)
- DÉCHETS RADIOACTIFS ou DÉCHETS NUCLÉAIRES
- ISOTOPES, biologie
- NUCLÉAIRE POLLUTION