Halogènes et composés dérivés
Articles
-
ASTATE
- Écrit par Universalis, Bernard PIRE
- 564 mots
Élément chimique de symbole At et de numéro atomique 85, l'astate (du grec astatos, instable) a autrefois été appelé ékaiode (car ses propriétés chimiques se rapprochent de celles de l'iode, l'halogène qui le précède dans le tableau périodique) et alabame. Les Anglo-Saxons le nomment...
-
BROME
- Écrit par Bertrand DREYFUS
- 423 mots
Du grec brômos, puanteur
Symbole chimique : Br
Numéro atomique : 35
Masse atomique : 79,904 g
Point de fusion : — 7,2 0C
Densité (à 20 0C) : 3,12.
Liquide rouge sombre d'odeur piquante, irrite la peau, les yeux et les voies respiratoires ; l'inhalation à l'état de vapeur est très dangereuse,...
-
BROMURE D'HYDROGÈNE
- Écrit par Universalis
- 309 mots
Formule brute : HBr
Masse moléculaire : 80,92 g
Point de fusion : — 88,5 0C
Point d'ébullition : — 67 0C
Température critique : 89,9 0C
Gaz de forte odeur piquante formant dans l'air un nuage lourd ; âcre et corrosif, il irrite fortement la peau et les muqueuses. Par abaissement de...
-
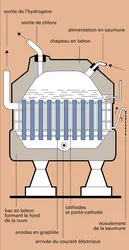
CHLORE
- Écrit par Henri GUÉRIN
- 5 625 mots
- 5 médias
-
CHLORURE D'HYDROGÈNE
- Écrit par Universalis
- 574 mots
Formule brute : HCl
Masse moléculaire : 36,46 g
Point d'ébullition : — 84,9 0C
Point de fusion : — 114 0C
Température critique : 51,54 0C.
Gaz incolore d'odeur forte et étouffante, très soluble dans l'eau (qui à la température ordinaire en dissout environ 450 fois son volume),...
-
FLUOR
- Écrit par Universalis, Josik PORTIER
- 2 393 mots
- 1 média
Élément chimique de symbole F et de numéro atomique 9, le premier de la famille des halogènes, le fluor est le plus électronégatif et le plus réactif de tous les éléments chimiques. C'est un gaz faiblement coloré en jaune verdâtre dont l'odeur très forte et irritante rappelle celle de l'ozone....
-
FLUORURE D'HYDROGÈNE
- Écrit par Bernard CARTON
- 614 mots
Formule brute : HF
Masse moléculaire : 20,01 g
Point d'ébullition : 19,5 0C
Point de fusion : — 83,1 0C
Température critique : 188 0C.
Gaz incolore d'odeur piquante fumant dans l'air.
Le fluorure d'hydrogène bout déjà à la température ordinaire, mais, refroidi, il forme un liquide...
-
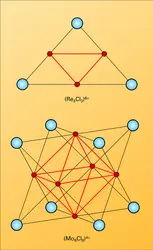
HALOGÈNES
- Écrit par Jacques METZGER, Robert de PAPE
- 6 600 mots
- 5 médias
-
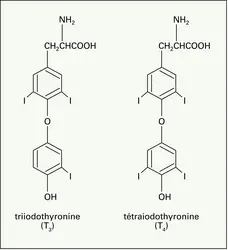
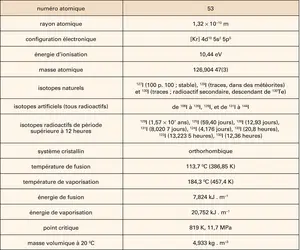
IODE
- Écrit par Pierre LASZLO
- 2 655 mots
- 2 médias
-
IODHYDRIQUE ACIDE
- Écrit par Bernard CARTON
- 246 mots
Formule brute : HI
Masse moléculaire : 127,91 g
Point d'ébullition : — 34 0C
Point de fusion : — 50,8 0C
Température critique : 150,5 0C.
Gaz incolore, d'odeur piquante fumant à l'air, se condensant en un liquide incolore, l'iodure d'hydrogène est très soluble dans l'eau, qui, à la...