HALOGÈNES
Composés oxygénés
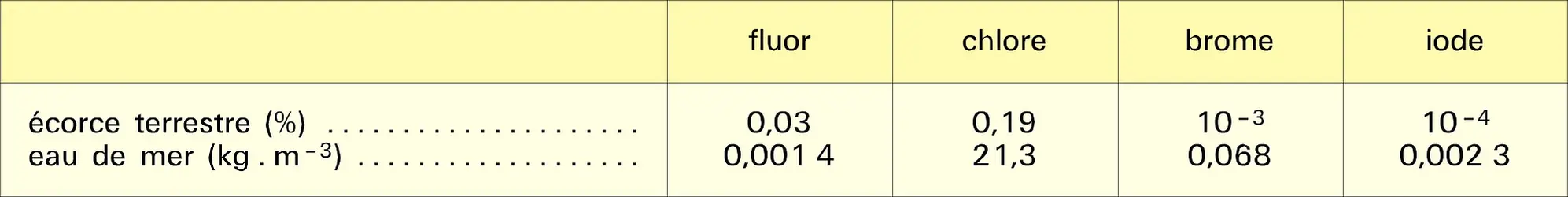
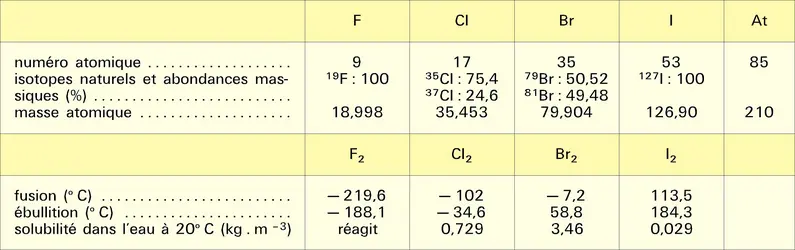
À cause de leur caractère électronégatif, les halogènes présentent dans les halogénures le degré d'oxydation formel — 1 ; ils sont susceptibles d'acquérir des degrés d'oxydation positifs si on les associe à un élément plus électronégatif qu'eux-mêmes, comme l'oxygène. Cette remarque ne s'applique pas au fluor, le plus électronégatif de tous les éléments, mais seulement au chlore, au brome et à l'iode, dont les principaux degrés d'oxydation positifs sont : I, III, IV, V et VII, ce dernier correspondant à la mobilisation de la totalité des électrons de valence.
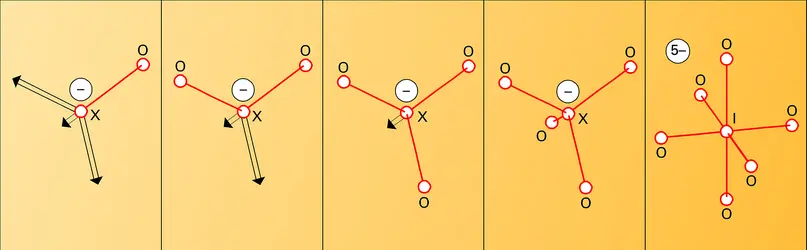
Les espèces oxydées sont électriquement neutres – comme le bioxyde de chlore ClO2 (ClIV), le pentoxyde d'iode I2O5 (IV) – ou ce sont des ions négatifs (fig. 3) – comme l'ion chlorate ClO–3 (CIV) ou l'ion paraperiodate IO65– (IVII). Ces anions sont associés à des cations alcalins, alcalino-terreux ou à Ag+ dans des composés salins, ou bien à des protons dans les acides correspondants, HClO3 et H5IO6.
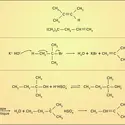
Sauf I2O5, les oxydes d'halogènes sont de formation endoénergétique ; leur préparation à partir des éléments exige donc un apport d'énergie qui peut être fourni par l'effluve électrique (O2F2, BrO2). Certains anhydrides d'acides, tels Cl2O7 et I2O5, sont obtenus en déshydratant les acides correspondants, HClO4 et HIO3. Mais le plus souvent on a recours aux nombreuses réactions de dismutation que subissent les degrés d'oxydation intermédiaires ; les halogènes eux-mêmes se dismutent en solution basique :
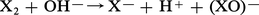
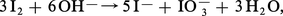
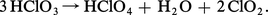
On utilise aussi l'action des halogènes sur les oxydants forts comme les chlorates ou l'acide nitrique :
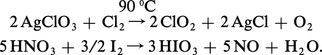
Instables, les oxydes d'halogènes se décomposent avec explosion sous l'effet d'un choc ou d'un léger chauffage ; ce sont des oxydants puissants, de même que les oxyacides qu'ils forment et leurs sels. Les chlorates alcalins comme KClO3 libèrent leur oxygène par chauffage brutal à 500 0C en laissant un résidu de chlorure alcalin et forment avec le soufre et le carbone des mélanges détonant au choc ; l'anhydride iodique I2O5 oxyde le monoxyde de carbone dès 70 0C, réaction utilisée pour doser ce dernier dans les mélanges gazeux :

L'instabilité des sels oxyhalogénés est surtout importante pour les composés de degrés d'oxydation intermédiaires, qui manifestent une forte tendance à la dismutation par simple chauffage. Si le chauffage est conduit avec précautions, le dernier terme des dismutations avant la décomposition totale en oxygène et halogénure est le composé de degré d'oxydation VII (perchlorate ou paraperiodate), qui se révèle ainsi le moins instable :
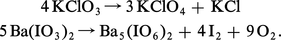
Les acides correspondants, l'acide perchlorique HClO4 et l'acide paraperiodique H5IO6, présentent également une certaine stabilité. Le premier ne manifeste pas son caractère oxydant à froid et en solution aqueuse ; celle-ci, par exemple, réagit sur un métal réducteur comme le zinc uniquement par ses protons :
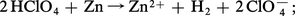
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
- Robert de PAPE : maître de conférences à la faculté des sciences du Mans
Classification
Pour citer cet article
Jacques METZGER et Robert de PAPE. HALOGÈNES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALCÈNES ou OLÉFINES
- Écrit par Jacques METZGER
- 3 640 mots
- 4 médias
-
ALCYNES
- Écrit par Jacques METZGER
- 3 301 mots
- 5 médias
-
ASTATE
- Écrit par Universalis, Bernard PIRE
- 564 mots
Élément chimique de symbole At et de numéro atomique 85, l'astate (du grec astatos, instable) a autrefois été appelé ékaiode (car ses propriétés chimiques se rapprochent de celles de l'iode, l'halogène qui le précède dans le tableau périodique) et alabame. Les Anglo-Saxons le nomment...
-
ATMOSPHÈRE - Chimie
- Écrit par Marcel NICOLET
- 3 553 mots
- 5 médias
- Afficher les 14 références
Voir aussi
- CYANOGÈNE
- CHLORURE DE VINYLE
- ÉLECTRONÉGATIVITÉ
- DENSITÉ
- ANHYDRIDES
- HALOGÉNÉS DÉRIVÉS
- HYDRACIDES
- MARKOVNIKOV RÈGLE DE
- ALKYLATION ou ALCOYLATION
- FRIEDEL & CRAFTS RÉACTIONS DE
- DEGRÉ D'OXYDATION
- WURTZ MÉTHODE DE
- OXYDANTS
- DISMUTATION, chimie
- ÉLIMINATION, chimie
- HALOGÉNURES INSATURÉS
- ÉLÉMENTS CHIMIQUES
- CLUSTER
- CYANURES
- CYANATES
- NUCLÉOPHILES SUBSTITUTIONS
- PSEUDO-HALOGÈNES
- TÉFLON ou POLYTÉTRAFLUOROÉTHYLÈNE (PTFE)
- WILLIAMSON RÉACTION DE
- CYANURE DE SODIUM
- CHLOROFORME
- FLUORHYDRIQUE ACIDE
- IODURE D'HYDROGÈNE
- CYANURATION
- CYANHYDRIQUE ACIDE
- FLUIDES FRIGORIGÈNES
- OXYDES
- HALOGÉNURES
- RÉACTIVITÉ CHIMIQUE
- POLYCHLORURE DE VINYLE (PVC) ou CHLORURE DE POLYVINYLE
- TEMPÉRATURE D'ÉBULLITION
- HALOGÉNURES D'ALCÉNYLE
- HALOGÉNURES D'ALKYLE
- HALOGÉNURES D'ARYLE
- CHLOROFLUOROCARBURES (CFC)