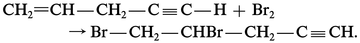HALOGÈNES
Caractère oxydant ; halogénures
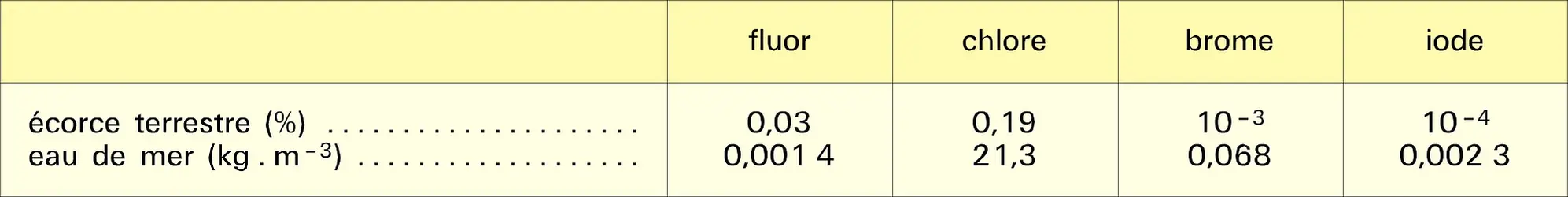
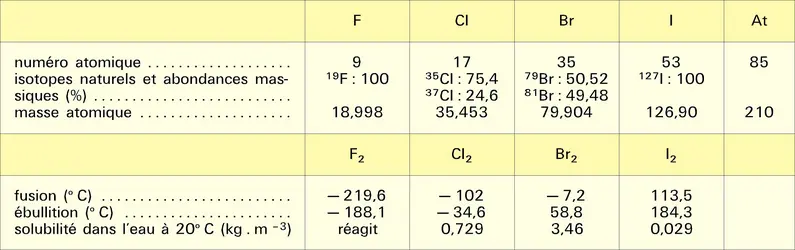
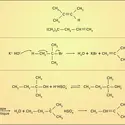
Dans leurs réactions avec les autres éléments et leurs composés, les halogènes manifestent généralement un fort caractère électronégatif, c'est-à-dire une tendance marquée à leur arracher des électrons pour former des ions F–, Cl–, Br– ou I–. C'est le fluor qui possède cette propriété au plus haut degré, le caractère électronégatif des halogènes plus lourds diminuant progressivement. Les réactions sont particulièrement violentes avec les éléments métalliques comme le sodium, le magnésium, le fer, qui brûlent dans les halogènes gazeux en formant des halogénures :
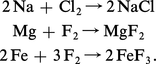
Les halogénures des métaux très réducteurs comme les alcalins (sodium, potassium) ou les alcalino-terreux (magnésium, calcium) sont des solides blancs bien cristallisés, aux points de fusions élevés, et dont les structures sont constituées d'un agrégat tridimensionnel d'anions et de cations liés par des forces électrostatiques. Les éléments de transition donnent également des halogénures ioniques, mais seulement aux degrés d'oxydation peu élevés ; leurs colorations dépendent à la fois de la nature de l'ion métallique et de l'halogène qui lui est associé.
Les halogénures des métaux sont généralement solubles dans l'eau, sauf les fluorures de plomb et des alcalino-terreux, les iodures PbI2 et HgI2, et les halogénures d'argent AgCl, AgBr et AgI, dont la formation constitue un critère d'identification des halogènes ; en revanche, le fluorure d'argent AgF est très soluble.
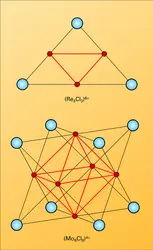
Un aspect curieux et moderne de la chimie des halogénures a fait l'objet de recherches intensives : il s'agit des clusters. Dans certains halogénures d'éléments de transition lourds (tels Nb6Br12, Re3Cl9), l'élément de transition semble être à un degré d'oxydation bas, quelquefois fractionnaire (comme dans Nb6F15 et Ta6I14). En réalité, l'étude détaillée des structures cristallines a révélé que les atomes métalliques se réunissaient par 3 ou 6 en constituant des grappes (traduction de l'anglais clusters) par l'intermédiaire de liaisons directes rappelant celles observées dans les métaux eux-mêmes ; des atomes d'halogènes établissent des liaisons supplémentaires constituant avec le groupe d'atomes métalliques un gros cation (fig. 1).
Ces composés sont solubles et recristallisables dans les solutions aqueuses acides, mais sont oxydés par l'eau en solution alcaline avec dégagement de dihydrogène.
Beaucoup de non-métaux réagissent également avec les halogènes ; l'arsenic pulvérulent, par exemple, s'enflamme spontanément dans le dichlore :
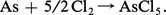
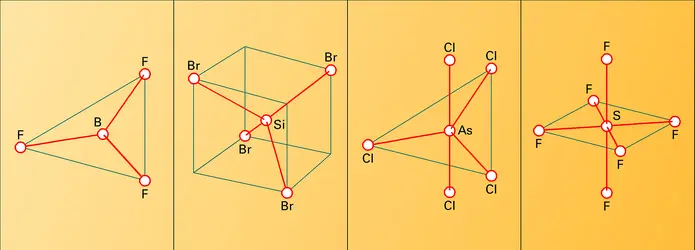
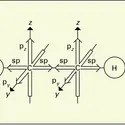
Les halogénures formés sont moléculaires, et de ce fait présentent des températures d'ébullition relativement basses ; on doit admettre que le transfert d'électron de l'élément sur l'halogène n'est pas total et que les liaisons qui s'établissent sont d'un type covalent et dirigé ; la géométrie des molécules dépend étroitement du nombre d'électrons de l'élément et des orbitales atomiques dont il dispose (fig. 2).
Ces composés sont attaqués par l'eau avec formation d'halogénure d'hydrogène, réactions d'hydrolyse souvent violentes dès la température ordinaire :
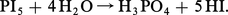
L'action du dihydrogène sur les halogènes conduit à la formation d'halogénures d'hydrogène, composés gazeux d'odeur acide :
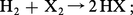
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
- Robert de PAPE : maître de conférences à la faculté des sciences du Mans
Classification
Pour citer cet article
Jacques METZGER et Robert de PAPE. HALOGÈNES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALCÈNES ou OLÉFINES
- Écrit par Jacques METZGER
- 3 640 mots
- 4 médias
-
ALCYNES
- Écrit par Jacques METZGER
- 3 301 mots
- 5 médias
-
ASTATE
- Écrit par Universalis, Bernard PIRE
- 564 mots
Élément chimique de symbole At et de numéro atomique 85, l'astate (du grec astatos, instable) a autrefois été appelé ékaiode (car ses propriétés chimiques se rapprochent de celles de l'iode, l'halogène qui le précède dans le tableau périodique) et alabame. Les Anglo-Saxons le nomment...
-
ATMOSPHÈRE - Chimie
- Écrit par Marcel NICOLET
- 3 553 mots
- 5 médias
- Afficher les 14 références
Voir aussi
- CYANOGÈNE
- CHLORURE DE VINYLE
- ÉLECTRONÉGATIVITÉ
- DENSITÉ
- ANHYDRIDES
- HALOGÉNÉS DÉRIVÉS
- HYDRACIDES
- MARKOVNIKOV RÈGLE DE
- ALKYLATION ou ALCOYLATION
- FRIEDEL & CRAFTS RÉACTIONS DE
- DEGRÉ D'OXYDATION
- WURTZ MÉTHODE DE
- OXYDANTS
- DISMUTATION, chimie
- ÉLIMINATION, chimie
- HALOGÉNURES INSATURÉS
- ÉLÉMENTS CHIMIQUES
- CLUSTER
- CYANURES
- CYANATES
- NUCLÉOPHILES SUBSTITUTIONS
- PSEUDO-HALOGÈNES
- TÉFLON ou POLYTÉTRAFLUOROÉTHYLÈNE (PTFE)
- WILLIAMSON RÉACTION DE
- CYANURE DE SODIUM
- CHLOROFORME
- FLUORHYDRIQUE ACIDE
- IODURE D'HYDROGÈNE
- CYANURATION
- CYANHYDRIQUE ACIDE
- FLUIDES FRIGORIGÈNES
- OXYDES
- HALOGÉNURES
- RÉACTIVITÉ CHIMIQUE
- POLYCHLORURE DE VINYLE (PVC) ou CHLORURE DE POLYVINYLE
- TEMPÉRATURE D'ÉBULLITION
- HALOGÉNURES D'ALCÉNYLE
- HALOGÉNURES D'ALKYLE
- HALOGÉNURES D'ARYLE
- CHLOROFLUOROCARBURES (CFC)