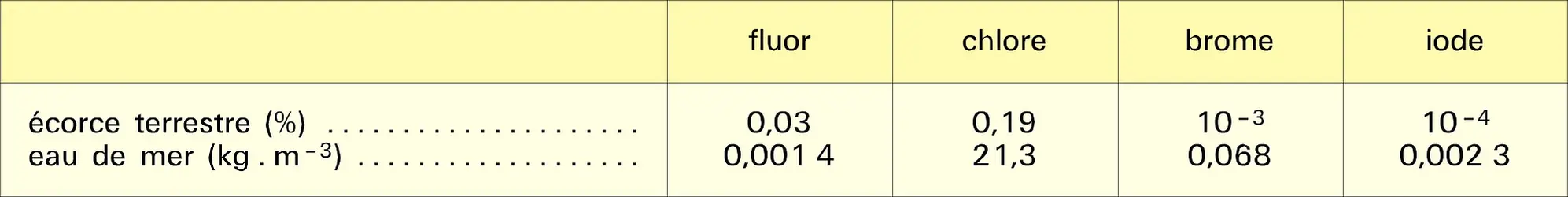
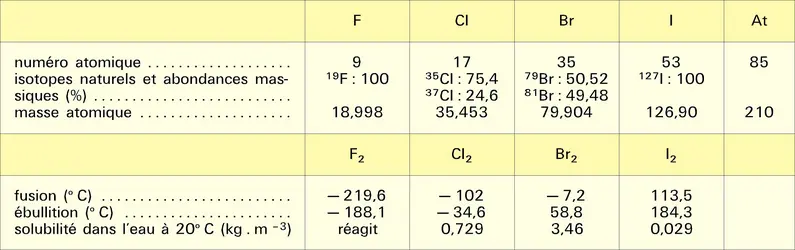
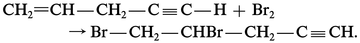HALOGÈNES
Pseudohalogènes
Les pseudohalogènes n'ont pas tous été préparés à l'état libre, mais leurs formes réduites, qui sont les homologues des ions halogénures, sont mieux connues. Les ions pseudohalogénures les plus importants sont l'ion cyanure CN–, l'ion thiocyanate SCN–, l'ion cyanate OCN– et l'ion azoture N–3 ; l'association des atomes qui les constituent est de nature covalente, avec participation de liaisons σ et π. Ces anions sont le plus souvent associés à des cations alcalins sous la forme de composés salins comme le cyanure de sodium NaCN ; les acides correspondants, contrairement à HCl, HBr et HI, sont faiblement dissociés en solution aqueuse, mais les pseudohalogénures d'argent ont en commun avec AgCl, AgBr et AgI leur caractère insoluble.
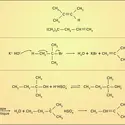
Les cyanures alcalins sont très stables, ce qu'on interprète en observant que l'ion CN– a même structure électronique que la molécule de diazote N2, qui est particulièrement, inerte. Le cyanure de sodium, à cause de ses nombreuses applications – extraction de l'or, bains de galvanoplastie, photographie – fait l'objet d'une industrie importante ; sa synthèse passe généralement par un dérivé du carbure de calcium, la cyanamide calcique Ca(CN2), que l'on convertit en présence d'un réducteur et d'un sel de sodium :
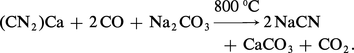
On prépare les pseudohalogènes en faisant subir aux ions correspondants une oxydation ménagée ; dans le cas du cyanogène, on peut utiliser un sel cuivrique, qui oxyde CN– en solution aqueuse :

Les pseudohalogènes connus sont des substances volatiles résultant de la combinaison symétrique de deux radicaux ; le cyanogène, par exemple, a la structure :

Les cyanures possèdent à un plus haut degré que les ions halogénures la propriété de former des complexes de coordination extrêmement stables avec les éléments de transition. La liaison se fait par l'intermédiaire de l'atome de carbone, qui cède un doublet électronique à l'ion de transition ; avec l'argent et l'or monovalents, les complexes sont linéaires :
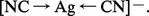
L'affinité de l'or pour les ions cyanures est si grande qu'il perd en leur présence son caractère de métal noble ; il s'oxyde à l'air en donnant un complexe soluble :
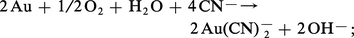
Les cyanures et l'acide cyanhydrique sont des toxiques extrêmement violents ; ils doivent leur nocivité à une complexation du fer par CN– dans la molécule d'hémoglobine, inhibant ainsi le phénomène de respiration.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
- Robert de PAPE : maître de conférences à la faculté des sciences du Mans
Classification
Pour citer cet article
Jacques METZGER et Robert de PAPE. HALOGÈNES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALCÈNES ou OLÉFINES
- Écrit par Jacques METZGER
- 3 640 mots
- 4 médias
-
ALCYNES
- Écrit par Jacques METZGER
- 3 301 mots
- 5 médias
-
ASTATE
- Écrit par Universalis, Bernard PIRE
- 564 mots
Élément chimique de symbole At et de numéro atomique 85, l'astate (du grec astatos, instable) a autrefois été appelé ékaiode (car ses propriétés chimiques se rapprochent de celles de l'iode, l'halogène qui le précède dans le tableau périodique) et alabame. Les Anglo-Saxons le nomment...
-
ATMOSPHÈRE - Chimie
- Écrit par Marcel NICOLET
- 3 553 mots
- 5 médias
- Afficher les 14 références
Voir aussi
- CYANOGÈNE
- CHLORURE DE VINYLE
- ÉLECTRONÉGATIVITÉ
- DENSITÉ
- ANHYDRIDES
- HALOGÉNÉS DÉRIVÉS
- HYDRACIDES
- MARKOVNIKOV RÈGLE DE
- ALKYLATION ou ALCOYLATION
- FRIEDEL & CRAFTS RÉACTIONS DE
- DEGRÉ D'OXYDATION
- WURTZ MÉTHODE DE
- OXYDANTS
- DISMUTATION, chimie
- ÉLIMINATION, chimie
- HALOGÉNURES INSATURÉS
- ÉLÉMENTS CHIMIQUES
- CLUSTER
- CYANURES
- CYANATES
- NUCLÉOPHILES SUBSTITUTIONS
- PSEUDO-HALOGÈNES
- TÉFLON ou POLYTÉTRAFLUOROÉTHYLÈNE (PTFE)
- WILLIAMSON RÉACTION DE
- CYANURE DE SODIUM
- CHLOROFORME
- FLUORHYDRIQUE ACIDE
- IODURE D'HYDROGÈNE
- CYANURATION
- CYANHYDRIQUE ACIDE
- FLUIDES FRIGORIGÈNES
- OXYDES
- HALOGÉNURES
- RÉACTIVITÉ CHIMIQUE
- POLYCHLORURE DE VINYLE (PVC) ou CHLORURE DE POLYVINYLE
- TEMPÉRATURE D'ÉBULLITION
- HALOGÉNURES D'ALCÉNYLE
- HALOGÉNURES D'ALKYLE
- HALOGÉNURES D'ARYLE
- CHLOROFLUOROCARBURES (CFC)