ORGANIQUE CHIMIE
Les théories de la chimie organique
À peine promue au rang des véritables sciences après Lavoisier, la chimie organique devait connaître un essor prodigieux entre 1800 et 1900 ; de quelques dizaines de produits naturels elle passait à quelque 350 000 composés, dont la majorité provenaient de semi-synthèses. On comprendrait mal ces progrès si l'on faisait abstraction des théories qui les ont largement épaulés.
Laissant de côté la théorie des types dont tout le mérite revient à Laurent et Gerhardt, on abordera tout d'abord la théorie de la valence. C'est un concept à la fois très général et très flou, commun à ses débuts à la chimie minérale et à la chimie organique : ainsi, l'univalence de l'hydrogène, du chlore, du sodium était admise tant par les minéralistes que par les organiciens. Cependant, la « valence des organiciens » repose sur des considérations toutes différentes de celles des minéralistes.
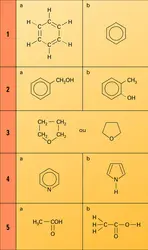
Le point de départ est l'existence de l' isomérie. Si à la formule très simple CH4O correspond un seul composé défini, le méthanol, déjà à la formule C2H6O correspondent deux composés, l'éthanol et l'oxyde de méthyle, de propriétés physiques et chimiques totalement différentes ; à une formule moyennement compliquée, telle que : C12H17O2N, correspondraient des centaines de composés très différents. On a donné le nom d'isomères à ces corps de même formule brute, mais nettement différents. Il était naturel de considérer que la molécule était alors constituée du même nombre des mêmes atomes, mais que l'enchaînement de ceux-ci était différent dans les divers isomères, ce qui entraîne la notion de « formule développée plane » (le mot plane spécifiant qu'il ne s'agit jusqu'ici que de l'ordre de succession des atomes et non de leur disposition spatiale et que la formule peut être décrite dans un plan). Il est démontré dans l'article stéréochimie que la formule plane n'implique nullement l'unicité des composés qu'elle représente et qu'il est indispensable de recourir à la disposition spatiale des atomes ; mais cela n'est nullement nécessaire pour introduire la notion de « valence des organiciens ».
Du point de vue historique, l'établissement des formules développées planes repose sur deux principes : l'existence des atomes, entités insécables, et la normalité des substitutions (absence de transpositions). Le cas de l'acide acétique est classique : c'est un composé ternaire CαHβOγ. L'oxyde d'argent lui enlève le quart de son hydrogène ; β est donc égal à 4 ou à un multiple de 4. Le chlore lui enlève successivement le quart, la moitié, les trois quarts de son hydrogène, alors que le quatrième quart disparaît encore sous l'action de l'oxyde d'argent, d'où la formule provisoire H3(CαOγ)H. Le perchlorure de phosphore lui enlève le quart de l'hydrogène et la moitié de l'oxygène ; γ est donc égal à 2 ou à un multiple de 2, et cela fait pressentir le voisinage d'un hydrogène et d'un atome d'oxygène, d'où le schéma plus explicite H3(CαO)OH. Enfin, la pyrogénation conduit au gaz carbonique et au méthane, d'où la présomption qu'il existe deux atomes de carbone et que deux atomes d'oxygène sont unis à l'un d'eux et au moins trois des atomes d'hydrogène à un autre atome de carbone, ce qui conduit à la formule provisoire 5 a. En représentant par des tirets les proximités des atomes, on arrive à la formule b, très proche de celle universellement admise aujourd'hui.
Il faut toutefois remarquer que l'on pouvait seulement écrire β = 4n, γ = 2n, α = 2n, et non β = 4, γ = 2, α = 2, et que la dernière réaction invoquée, la scission en méthane et en gaz carbonique,[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
- Charles PRÉVOST : professeur à la faculté des sciences de Paris, à l'École centrale des arts et manufactures de Paris et à l'École normale supérieure de Fontenay-aux-Roses
Classification
Pour citer cet article
Jacques METZGER et Charles PRÉVOST. ORGANIQUE CHIMIE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Média
Autres références
-
ACÉTALS
- Écrit par Jacques METZGER
- 866 mots
- 1 média
Les acétals sont les composés gem-dialcoxylés c'est-à-dire qui portent sur le même atome de carbone tétracoordiné de la chaîne deux fonction éther-oxyde. Ils dérivent formellement de l'élimination d'une molécule d'eau entre un dérivé carbonylé et deux molécules d'alcool (réaction 1). On distingue...
-
ACÉTAMIDE (éthanamide)
- Écrit par Dina SURDIN
- 328 mots
CH3—CO—NH2
Masse moléculaire : 59,07 g
Masse spécifique : 1,16 g/cm3
Point de fusion : 82 0C
Point d'ébullition : 222 0C.
Monoamide primaire se présentant en cristaux blancs hexagonaux ou rhomboédriques. La structure cristalline de l'acétamide déterminée par les rayons X (méthode du...
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 111 mots
- 3 médias
L'acide acétique, acide organique de formule CH3COOH, est le membre le plus important de la famille des acides carboxyliques. Il joue avec ses dérivés un rôle essentiel dans de nombreuses synthèses et dégradations biologiques accompagnant le métabolisme des aliments et la formation des tissus....
-
ACÉTYLACÉTIQUE ESTER
- Écrit par Jacques METZGER
- 1 355 mots
- 2 médias
L'acide acétylacétique est le nom usuel du butanone-3-oïque :
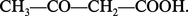
Cet acide a été isolé dans les urines pathologiques. Il peut être obtenu par une hydrolyse prudente de son ester éthylique. Ce dernier, beaucoup plus important, est un intermédiaire utilisé dans l'industrie pharmaceutique et dans...
- Afficher les 158 références
Voir aussi