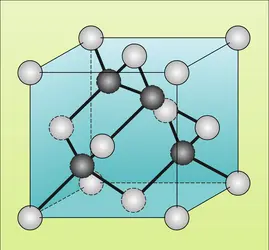
CARBONE
Composés
Composés d'insertion
La structure très particulière du graphite (couches planes faiblement liées les unes aux autres) rend possible l'insertion d'atomes étrangers entre ces couches.
La structure rigide des carbones non graphitables rend difficile l'écartement des plans d'hexagones d'atomes ; dans les carbones graphitables, il existe une possibilité d'insertion d'atomes entre ces plans ; mais ceux-ci sont peu étendus et ainsi l'influence des bords de feuillets y est plus importante que dans le graphite, ce qui conduit à des composés d'insertion de compositions variées. On se rapproche d'autant plus des valeurs d'insertion obtenues avec le graphite que le carbone graphitable a été chauffé à température plus élevée et se trouve plus graphité.
Des composés d'insertion ont été obtenus avec le potassium, le césium, le fluor, le brome, des chlorures (parmi lesquels le chlorure ferrique a donné un produit très étudié), des oxydes, des sulfures, des acides concentrés (sulfurique, nitrique). Avec le fluor, par exemple, on obtient des produits de formules CF ou C4F ; avec le potassium C24K et C8K entre autres. Des produits d'oxydation particuliers du type insertion ont été obtenus avec des mélanges oxydants tels que le chlorate de potassium en présence d'acide nitrique. Ces produits ont été appelés acides ou oxydes graphitiques.
Halogénures
Plusieurs composés binaires de fluor et de carbone sont connus : CF4, C2F6, C3F8... Ils sont gazeux à la température ordinaire et se forment surtout par chauffage au rouge du composé d'insertion CF. La composition de ce dernier peut varier entre CF0,68 et CF0,99 et il est obtenu par action du fluor sur le graphite à 420-450 0C sous la pression atmosphérique, les atomes de fluor formant une couche de part et d'autre de chaque couche de carbone. Il existe un autre composé d'insertion, le composé solide C4F dont la formule peut varier entre C4F et C3,6F et qui est obtenu par passage d'un mélange de fluor et d'acide fluorhydrique sur le graphite à la température ordinaire.
Le tétrachlorure de carbone CCl4 ne peut se préparer par action directe du chlore sur le carbone. Ce corps est l'objet d'une fabrication industrielle et peut être obtenu par la réaction :
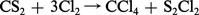
L' oxychlorure de carbone COCl2, appelé encore phosgène, se forme par addition du chlore sur l'oxyde de carbone. C'est un gaz incolore, suffocant, extrêmement toxique, qui fut utilisé comme gaz de combat pendant la Première Guerre mondiale. Chlorure d'acide de l'acide carbonique, l'eau le décompose assez rapidement en libérant l'anhydride :

C'est un intermédiaire des industries des colorants et des produits pharmaceutiques.
Le tétrabromure et le tétraiodure de carbone sont solides à la température ordinaire et on connaît différents autres dérivés oxyhalogénés du carbone tels que l'oxyfluorure COF2 gazeux à la température ordinaire et l'oxybromure COBr2 liquide très toxique.
Oxydes
Trois composés binaires du carbone et de l'oxygène, de formules respectives C3O2, CO et CO2 sont connus. Seuls les deux derniers sont importants.
Le sous-oxyde C3O2 est un liquide toxique. Il est obtenu soit par décomposition thermique sous pression réduite de l'anhydride diacétyltartrique ou de l'acide malonique en présence d'anhydride phosphorique. Peu stable, il se polymérise en un solide rouge. Il se comporte[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean AMIEL : ancien élève de l'École nationale supérieure de physique et de chimie de Paris, agrégé de physique, professeur honoraire de chimie générale à l'université de Paris-VI-Pierre-et-Marie-Curie
- Henry BRUSSET : docteur ès sciences, professeur honoraire de l'université de Paris-VI et de l'École centrale des arts et manufactures
Classification
Pour citer cet article
Jean AMIEL et Henry BRUSSET. CARBONE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER, Gérard FESSIER, Guy HENRY, Joëlle PONTET
- 14 176 mots
- 10 médias
Cette existence des deux variétés allotropiques du fer joue un grand rôle pour les propriétés de l'acier.Le fait essentiel réside dans la différence de solubilité du carbone dans chacune de ces formes. Alors que cette solubilité du carbone est nulle ou extrêmement faible dans le fer α, elle est... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
...aux plus gros efforts dans les trains d'atterrissage des avions (cf. acier – Technologie). L'acier le plus simple est un alliage de fer et de carbone, renfermant moins de 2 p. 100 en poids de carbone (9 atomes pour 100). Il faut rappeler que le carbone n'est pas lui-même un métal, mais que le... -
ASTROCHIMIE
- Écrit par David FOSSÉ, Maryvonne GERIN
- 4 388 mots
- 3 médias
...hydrocarbures simples subsistent malgré les conditions de rayonnement. On s'aperçoit donc que les chemins de la synthèse moléculaire dans l'espace sont variés. Il existe cependant un dénominateur commun aux espèces détectées dans le milieu interstellaire : elles contiennent pratiquement toutes du carbone. Comme... -
AUTOTROPHIE & HÉTÉROTROPHIE
- Écrit par Alexis MOYSE
- 2 503 mots
- 2 médias
Le carbone minéral assimilable étant sous la forme de gaz carbonique ou d'ions carbonate ou bicarbonate, l'autotrophie complète suppose la capacité de fixer ces substances et de les réduire, c'est-à-dire de passer du composé CO2 à des constituants dans lesquels les atomes de carbone,... - Afficher les 48 références
Voir aussi
- PYROCARBONE
- SULFURE DE CARBONE
- TÉTRACHLORURE DE CARBONE
- PHOSGÈNE (oxychlorure de carbone)
- BOUDOUART RÉACTION DE
- SABATIER & SENDERENS RÉACTION DE
- CARBONIQUE ACIDE
- CARBONATE DE SODIUM
- XANTHIQUES ACIDES
- CYANOGÈNE
- CARBONYLES MÉTALLIQUES
- ISOTOPES
- RADIOÉLÉMENTS ou RADIONUCLÉIDES ou ISOTOPES RADIOACTIFS
- EAU, physico-chimie
- DATATION RADIOCHRONOLOGIQUE ou ISOTOPIQUE, géologie
- CARBONE 14 DATATION PAR LE
- COMPOSÉS D'INSERTION
- SUBSTITUTION, chimie
- HYDRURES
- CARBURES
- HALOGÉNÉS DÉRIVÉS
- SYNTHÈSE DES CRISTAUX ou CRISTALLOGENÈSE, technologie
- ADDITION, chimie
- OXYDATION
- GRAPHITE
- CYANURES
- CARBONE 14
- OXYCHLORURES
- SOLVAY PROCÉDÉ
- CONFIGURATION ÉLECTRONIQUE
- ALLOTROPIE
- CYANHYDRIQUE ACIDE
- OXYDES
- HALOGÉNURES
- FLUORURES
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- NOIR DE CARBONE
- HYDROFORMYLATION ou RÉACTION OXO
- CARBONIQUE GAZ ou DIOXYDE DE CARBONE
- TRANSFERT D'ÉLECTRONS
- CARBURE DE SILICIUM