BISMUTH
Propriétés chimiques
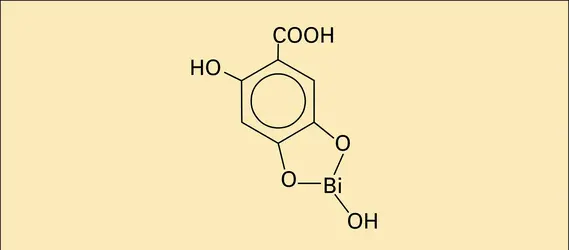
Les deux valences principales sont + 3 et + 5, la première étant, de loin, la plus importante. L'existence de composés chimiquement purs de Bi2+ et Bi4+ est incertaine. Le bismuth est stable à l'air même humide. Il s'oxyde cependant à froid, de façon superficielle, en gardant son aspect métallique. Chauffé au rouge, il brûle et conduit à l'oxyde Bi2O3, de caractère amphotère. L'hydrure H3Bi est très instable contrairement à H3As et H3Sb. Le bismuth décompose à chaud la vapeur d'eau et se combine aux halogènes chlore, brome et iode, pour donner des dérivés du bismuth III. Le trifluorure BiF3 s'obtient surtout par action de l'acide fluorhydrique HF sur l'oxyde ou l'hydroxyde. Le soufre réagit sur le métal en fusion : il se forme un sulfure Bi2S3 noir insoluble dans l'eau acidulée même à un pH voisin de 1. On le prépare beaucoup plus facilement par l'action de l'hydrogène sulfuré H2S ou du thioacétamide CH3CSNH2 sur une solution aqueuse d'un sel soluble. Ce sulfure ne se dissout pas dans le polysulfure d'ammonium, ce qui le distingue des sulfures d'antimoine et d'arsenic, propriété mise à profit en chimie analytique. Les acides non oxydants ne réagissent pas sur le bismuth. L'acide sulfurique concentré et l'acide nitrique conduisent, respectivement, avec libération d'anhydride sulfureux et de vapeurs nitreuses, au sulfate et au nitrate. Ce dernier sel s'obtient difficilement à l'état anhydre. L'hydrate le plus important, principale matière première dans la chimie du bismuth, répond à la formule Bi(NO3)3,5H2O. Particulièrement stable à sec, il donne, par simple dissolution dans l'eau, un nitrate basique dont la composition est définie par le mode de préparation. On doit noter au passage le caractère très hydrolysable des composés hydrosolubles, qu'on ne peut recristalliser qu'en milieu acide. Selon les conditions d'hydrolyse du nitrate, on obtient des produits différents : dans l'eau distillée, le sous-nitrate « lourd » (BiO)NO3,H2O ; en milieu légèrement alcalin, une variété « légère » renfermant du carbonate basique et de l'hydroxyde. Avec de l'acide gallique (polyphénol), il se forme un gallate basique de bismuth. La présence de polyols ou de sucres masque l'hydrolyse par formation de chélates solubles. On présente parfois les sels basiques comme des sels plus ou moins hydratés du cation bismuthyle BiO+.
Par calcination, les nitrates fournissent l'oxyde Bi2O3, propriété utilisée pour le dosage du bismuth dans ces composés. L'hydroxyde Bi(OH)3 a un caractère amphotère conduisant, en milieu alcalin fort, à l'ion BiO-2. Enfin, signalons l'existence, à côté d'oxyhalogénures BiOCl, BiOBr et BiOI, d'iodures complexes colorés en rouge. Une solution de triiodure BiI3 dans l'iodure de potassium constitue l'iodobismuthite de potassium KBiI4, plus connu sous le nom de réactif de Draggendorf. Celui-ci précipite avec de très nombreuses substances aminées et ses applications analytiques sont multiples.
Les composés dérivant du Bi5+ sont difficiles à obtenir. Ils sont instables et très oxydants. Les plus importants sont les bismuthates de coloration jaune orangé comme NaBiO3.
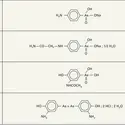
Les organobismuthiques sont plus rares et plus difficiles à obtenir que ceux des éléments du même groupe : azote, phosphore, arsenic et antimoine. À côté des bismuthines aliphatiques ou aromatiques, composés covalents préparés par action d'un organomagnésien mixte sur un halogénure de bismuth :

La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Anne-Marie TRISTANT : pharmacien conseil à la Sécurité sociale
Classification
Pour citer cet article
Anne-Marie TRISTANT. BISMUTH [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
AIMANTS
- Écrit par Roger FONTAINE
- 6 273 mots
- 13 médias
Le premier aimant fabriqué à partir de poudres a été élaboré en 1943, avant que la théorie des grains fins ne fasse son apparition. Il s'agit du composé intermétallique MnBi qui, cristallisant dans le système cubique, présente une anisotropie magnéto-cristalline très élevée. La préparation de la... -
ARSENIC
- Écrit par Jean PERROTEY
- 4 498 mots
- 2 médias
-
MÉTAL ARTS DU
- Écrit par Catherine ARMINJON
- 11 108 mots
- 2 médias
...mais la qualité des alliages permet de fabriquer en toute sécurité des étains destinés à tous les usages. Proche de l'étain et un peu plus fusible, le bismuth est un métal blanc argentin, légèrement jaunâtre, utilisé en alliage avec d'autres métaux tels que le plomb et l'étain, dont il augmente la dureté.... -
POLONIUM
- Écrit par Georges BOUISSIÈRES, Universalis
- 2 935 mots
- 2 médias
Des quantités pondérables (échelle du gramme) sont synthétisées à partir du bismuth que l'on soumet au flux neutronique intense d'un réacteur nucléaire. Le polonium 210 est formé suivant le processus :la section efficace de la capture des neutrons thermiques étant de 0,020 × 10...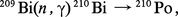
Voir aussi