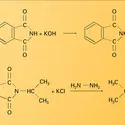
ALCÈNES ou OLÉFINES
Propriétés chimiques
La réactivité chimique des alcènes est caractérisée par la présence, au niveau du couple d'atomes doublement liés, d'une importante densité électronique (σ + π) assortie d'une polarisabilité élevée du doublet π. Elle se manifeste, de ce fait, vis-à-vis des réactifs électrophiles qui amorcent, avec les alcènes, des réactions d' addition. La possibilité de disposer, sur un carbone adjacent à la double liaison, d'une orbitale pz par départ d'un atome d'hydrogène, proton H+ ou atome neutre H., est favorisée par la conjugaison de cette orbitale avec celles (de même nature) des deux atomes doublement liés et conduit à des réactions de substitution sur cet atome en α (substitution en position allylique).
Additions
Hydrogénation
Le dihydrogène H2 s'additionne sur la double liaison des alcènes en présence de catalyseurs hétérogènes comme le platine et le palladium en phase liquide, à température ordinaire, et sous une légère pression ; on utilise le nickel de Raney en phase liquide et à température ordinaire, le nickel de Sabatier, en phase vapeur et à 150 0C. L'hydrogène, adsorbé sur le catalyseur, se fixe essentiellement en cis sur l'alcène, lui-même adsorbé. La vitesse de la réaction décroît lorsque le degré de substitution de la double liaison croît. On peut tirer parti de cette propriété cinétique pour hydrogéner sélectivement les doubles liaisons les moins encombrées d'un substrat.
La même addition d'hydrogène peut être réalisée en présence de catalyseur homogène comme RhCl(PPh3)3 (Wilkinson) qui permet l'hydrogénation des doubles liaisons éthyléniques sans perturber des groupes fonctionnels réductibles comme ester, nitro, cyano, carbonyle (addition essentiellement cis).
Hydrohalogénation
En l'absence de lumière et d'initiateurs de réactions radicalaires comme l'oxygène, les fluorure, chlorure, bromure et iodure d'hydrogène se fixent sur les alcènes à température ordinaire.
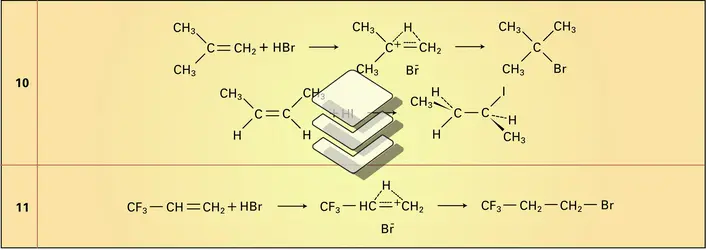
Le mécanisme de la réaction a été largement étudié ; il correspond à une addition électrophile de l'hydrogène H+ suivie par une addition nucléophile de l'halogène X- sur le composé formé (réactions 10). La stéréochimie de cette addition est normalement trans du fait de la difficulté d'approche, par le nucléophile X-, de la face de la double liaison déjà occupée par le proton. L'orientation ou régiosélectivité de l'attaque, par le nucléophile X-, du complexe intermédiaire résulte de la dissymétrie de la distribution électronique de ce complexe. La densité de charge positive de ce cation est maximale au niveau de l'atome de carbone le plus substitué ; c'est donc sur celui-ci que se fixe le nucléophile X- : cette règle d'orientation a été proposée, sur des bases expérimentales, par Markovnikov en 1870.
Certaines orientations d'additions, en apparente contradiction avec la règle empirique de Markovnikov, trouvent leur justification dans le fait que le carbone le plus substitué de la double liaison peut ne pas être celui sur lequel la charge cationique est la mieux stabilisée (réaction 11).
En présence d'initiateurs de réactions radicalaires comme les peroxydes et l'air ou de lumière, l'addition du bromure d'hydrogène sur les alcènes dissymétriques connaît une orientation opposée à celle de Markovnikov qui est appelée effet Kharasch : la réaction est radicalaire et l'attaque de la liaison π est le fait du radical Br., qui se porte sur l'atome de carbone le moins substitué, afin que l'intermédiaire radicalaire formé, le plus substitué, soit au maximum stabilisé :
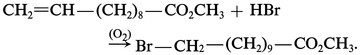
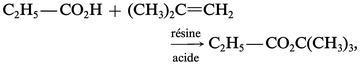
Oxacides
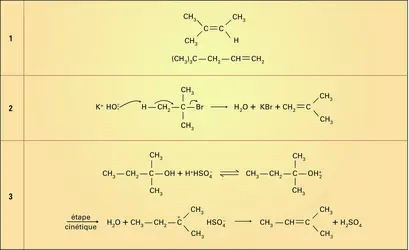
Les oxacides forts (H2SO4) et les acides carboxyliques, en présence de catalyseurs acides, se fixent en formant des esters :
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. ALCÈNES ou OLÉFINES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALCOOLS
- Écrit par Jacques METZGER
- 5 832 mots
- 8 médias
L'hydrolyse des esters sulfuriques d'alkyle, obtenus par addition de l'acide sur un alcène, est une réaction de ce type. -
ALCYNES
- Écrit par Jacques METZGER
- 3 301 mots
- 5 médias
Ces dérivés sont facilement obtenus par addition d'un halogène Cl2 ou Br2 à un alcène. Sous l'action de la potasse alcoolique, à température modérée, une première déshydrohalogénation a lieu, conduisant à un halogénure vinylique. La seconde est beaucoup plus difficile et nécessite des conditions... -
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
Addition sur les alcènes : l'aminomercuration de ces dérivés résulte de l'action d'une amine primaire ou secondaire et d'acétate mercurique. Le composé acétomercurique obtenu peut être réduit par NaBH4 et on obtient le produit d'addition de l'amine sur l'alcène (réaction). -
CARBOXYLIQUES ACIDES
- Écrit par Jacques METZGER
- 5 503 mots
- 6 médias
Deux procédés industriels mettent en œuvre l'addition, sur des oléfines, de CO + H2O : - Afficher les 14 références
Voir aussi
- POLYMÉRISATION
- POLYADDITION
- POLYÉTHYLÈNE
- PROPYLÈNE
- ÉTHYLÈNE
- ÉPOXYDATION
- PHOSPHINE (phosphure d'hydrogène)
- ORBITALES MOLÉCULAIRES
- HYDRATATION
- HYDROGÉNATION
- MARKOVNIKOV RÈGLE DE
- ISOMÉRISATION
- DOUBLE LIAISON ou LIAISON ÉTHYLÉNIQUE
- ALIPHATIQUES ou ACYCLIQUES COMPOSÉS
- ADDITION, chimie
- ALKYLATION ou ALCOYLATION
- DÉSAMINATION
- DÉSHYDROHALOGÉNATION
- DÉSHYDROGÉNATION
- ALDÉHYDES
- KHARASH EFFET
- OXACIDES ou OXOACIDES
- ÉLIMINATION, chimie
- DÉSHYDRATATION
- HALOGÉNATION
- ÉLECTRONIQUE STRUCTURE
- ZIEGLER-NATTA PROCÉDÉ
- MÉTATHÈSE, chimie
- NOMENCLATURE, chimie
- STÉRÉO-ISOMÉRIE
- RÉACTIVITÉ CHIMIQUE
- POLYOLÉFINES
- HYDROHALOGÉNATION
- HYDROBORATION
- OZONATION
- HYDROFORMYLATION ou RÉACTION OXO